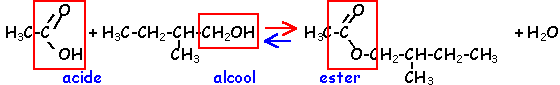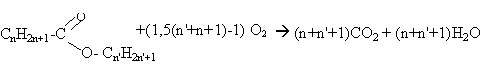En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
..
..
la réaction est totale
la réaction est limitée par l'hydrolyse de l'ester, athermique, lente
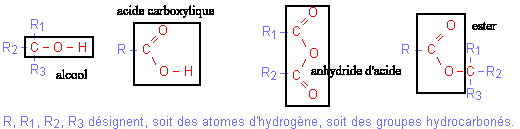
La réaction d'hydrolyse d'un ester est la réaction entre un ester et l'eau conduisant à un acide carboxylique et à un alcool. Cette réaction d'hydrolyse est la réaction inverse de la réaction d'estérification.
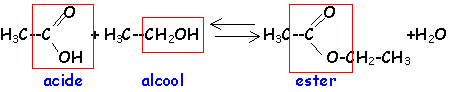
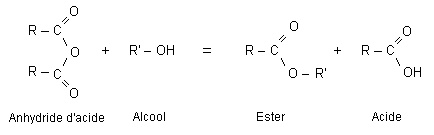
Estérification et hydrolyse constituent une réaction réversible aboutissant à un équilibre chimique où les quatre composés coexistent dans des proportions constantes ( équilibre dynamique : les deux réactions continuent d'avoir lieu mais avec des vitesses égales, la composition à l'équilibre ne change pas.).
comment atteindre plus rapidement l'équilibre ?
sans modifier la composition du mélange à l'équilibre
utiliser un catalyseur H3O+
élever la température
comment déplacer l'équilibre vers la formation de l'ester?
utiliser un réactif en excès
éliminer l'un des produit par distillation au fur et à mesure qu'il se forme
Influence de la nature des réactifs
Le taux d'avancement de l'estérification ne dépend pratiquement pas de la nature de l'acide carboxylique utilisé. Par contre la classe de l'alcool est déterminante comme le montre les valeurs indicatives concernant un mélange équimolaire d'acide et d'alcool données dans le tableau ci-dessous:
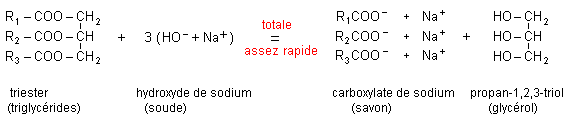
L'hydrolyse
basique d'un ester ( ou saponification) est la
réaction de l'ion hydroxyde HO - avec cet
ester.
On
obtient un ion carboxylate et un alcool.
La saponification d'un ester est une réaction assez
rapide et totale. L'avancement final est égal
à l'avancement maximal. Le taux d'avancement final
est égal à 1.
Les corps gras sont des triesters du propan-1, 2, 3-triol ( glycérol) et d'acides gras (acide à chaîne non ramifiée, à nombre pair d'atomes de carbone, en général de 10 à 20 atomes C).
Un savon est hydrophile, lipophile, amphiphile
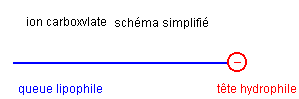
L’ion carboxylate du savon possède une extrémité négative attirée par l'eau. Cette extrémité est hydrophile (amie de l'eau).
L'ion carboxylate possède également une chaîne carbonée lipophile (amie des lipides ).
L'ion carboxylate possèdant une partie lipophile et une partie hydrophile est un amphiphile.
La partie hydrophile est lipophobe (peur des lipides) et la partie lipophile est hydrophobe (peur de l'eau).
Un savon est peu actif :
- dans une eau très calcaire car les ions carboxylate R – COO - constituants le savon précipitent avec l’ion Ca2+ ou Mg2+.
- en milieu acide car une partie des ions carboxylate disparaît ( déplacement de l'équilibre acide / base vers la forme acide AH)
- dans une eau salée car, en présence des ions Na+, l'équilibre suivant évolue vers la droite :
R-COO- (aq) + Na+ (aq) = R-COONa(s)
|
|
|
||||||||||||||
|
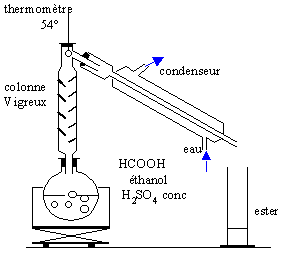
Dans le ballon du montage représenté on introduit 23g d'acide méthanoique , 23 g d'alcool pur, 1 mL d'acide sulfurique concentré et quelques grain de pierre ponce. Le chaufe ballon porte ce mélange à ébullition. vrai ou faux
|
 |
||||||||||||||
|
|
|||||||||||||||
|
|
|
||||||||||||||
|
la seconde affirmation est vraie. faux. l'ester, le plus volatil distille et le thermomètre indique 54 °C tant que l'ester distille, ensuite suivant l'intensité du chauffage la température agmente ou diminue vrai Ce dispositif élimine l'ester au fur et à mesure qu'il se forme. L'équilibre entre les 4 composés( alcool, acide ester et eau) est déplacé dans le sens formation de l'ester. Initialement , 0,5 mol d'acide et o,5 mol d'alcool :on peut , en théorie, obtenir à partir de 0,5 mol d'acide , 0,5 mol d'ester soit 37 g. |
|||||||||||||||
|
|
|||||||||||||||
|
|
|
||||||||||||||
|
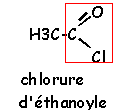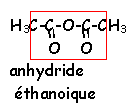
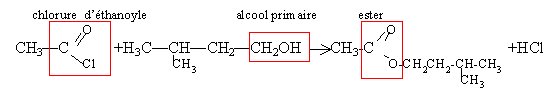
Réaction entre l'acide éthanoique et un alcool le 2-méthylbutan-1-ol noté B.
|
|||||||||||||||
|
|
|||||||||||||||
|
|
|
|
|
||||||||||||
|
|||||||||||||||
|
|
|||||||||||||||
|
|
|
||||||||||||||
|
La combustion de 5,1 g d'un ester fournit 11 g de dioxyde de carbone.
corrigé |
|||||||||||||||
|
ou bien CNH2NO2 + (1,5 N -1)O2 ---> N CO2 + N H2O
pourcentage massique : dans 44 g de CO2 il y a 12 g de carbone dans 11 g de CO2 il y a 3 g de carbone soit 3/5,1 *100= 58,8% de carbone en masse masse molaire de l'ester M= 12 N+2N+2*16
volume de dioxygène : masse molaire de l'ester : 5*12+10+32 =102 gmol-1. Qté de matière en mol d'ester : 5,1 / 102 =0,05 mol d'après l'équation bilan : 0,05 *(1,5*5-1)=0,05*6,5 =0,325 mol dioxygène soit en volume : 22,4 *0,325 = 7,28 L
|
|||||||||||||||
|
|
|||||||||||||||