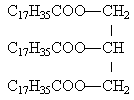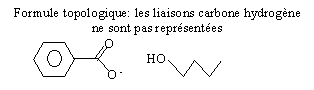En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
..
..
| .
. |
elle conduit à un alcool et à un carboxylate de sodium
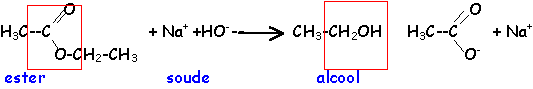
une extrémité lipophile, amie des graisses
et une extrémité hydrohpile , le groupe -COO-
|
|
|
||
|
On saponifie totalement 28,5 g d'un corps gras en utilisant 50 mL de soude de concentration égale à 2 mol L-1.Le corps gras est un triglycéride dont les 3 chaines carbonées sont identiques. Pour doser la quantité de soude en excès, il faut 4 mL d'acide chlorhydrique molaire (1 mol L-1.)
|
|
||
|
|
|||
|
|
|
||
|
au départ, 0,1 mol de soude ; 0,096 mol de soude on réagit avec 0,096 /3 mol de triester 0,032 mol de triglycéride vrai vrai 28,5 grammes divisé par 0,032 mol donne 890 g mol-1. faux masse molaire de la formule brute proposée 60*12+104+6*16 =920 g mol-1. la dernière affirmation est vraie |
|||
|
|
|||
|
|
|
||
|
Dans un ballon on introduit 8,9 g de benzoate de butyle, 20 mL d'hydroxyde de sodium à 4 molL-1 et quelques grains de pierre ponce. On chauffe à reflux pendant 30 min. Le mélange obtenu est refroidi, puis on y ajoute 20 mL d'acide chlorhydrique à 5 molL-1 .: l'acide benzoique précipite. Après filtration, rinçage et séchage, la masse de cet acide est : m=5,2g.
|
|||
|
corrigé |
|||
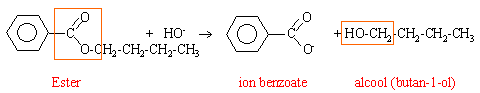
Quantité de matière des réactifs : ester : 8,9 / (12*11+14+32)= 0,05 mol (réactif limitant) soude : 4*20/1000= 0,08 mol (excès de 0,03 mol) rendement il se forme 0,05 mol d'acide benzoique à partir de 0,05 mol d'ester. masse théorique de cet acide : 0,05*(12*7+6+32)= 6,1 g rendement : 5,2 *100/ 6,1 =86%
identifier cet acide chromatographie sensible aux rayons ultra-violets (le noyau benzénique absorbe les UV) mesure du point de fusion de l'acide benzoique solide |
|||
|
retour - menu |
|||