Partie C – Étude de la cinétique de l’hydrolyse de l’aspirine
La stabilité d’un médicament dans différents milieux et conditions expérimentales est étudiée en
pharmacologie.
On se propose d’étudier la cinétique de la transformation entre l’aspirine et l’eau, à température
ambiante. Cette transformation lente forme de l’acide salicylique C
7H
6O
3 et de l’acide éthanoïque
C
2H
4O
2
.
La réaction entre l’aspirine et l’eau est appelée hydrolyse de l’aspirine et a pour équation de
réaction :
C
9H
8O
4
(aq) + H
2O(ℓ) = C
7H
6O
3
(aq) + C
2H
4O
2
(aq)
L’hydrolyse de l’aspirine est suivie par spectrophotométrie en présence d’un excès de chlorure de
fer III, FeCl
3(aq). En effet, ce dernier réagit avec l’acide salicylique pour former une espèce
chimique violette.
On considère que :
• l’absorbance du mélange à la longueur d’onde choisie ne dépend que de la concentration
en acide salicylique ;
• l’eau étant en excès, la réaction d’hydrolyse de l’aspirine est totale.
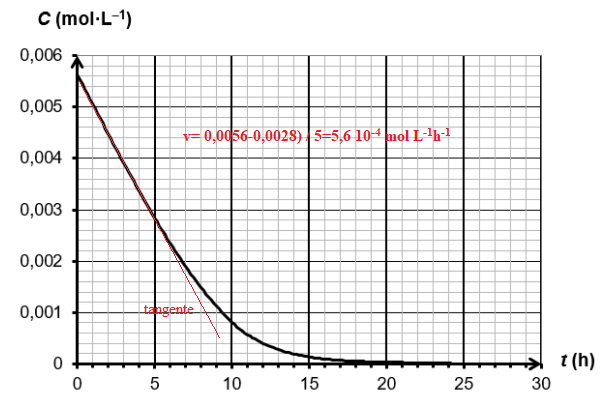
On mesure l’absorbance du mélange au cours du temps, à température constante, et on en déduit
l’évolution temporelle de la concentration en quantité de matière C de l’aspirine représentée sur la
figure suivante.
7. Définir la vitesse volumique de disparition de l’aspirine.
v = - d[C
C9H8O4
(aq) ] / dt.
8. Déterminer la vitesse volumique de disparition de l’aspirine à la date t = 0 h en faisant
apparaître la construction employée sur la figure .
 9.
9. Justifier sans calcul, à l’aide de la figure, comment évolue la vitesse volumique de disparition de l’aspirine au cours du
temps.
Les tangentes à la courbe sont de moins en moins inclinées sur l'horizontale. La vitesse volumique diminue au cours du temps.
On donne ci-dessous un extrait du code Python permettant de tracer la
courbe de lci-dessus représentant les valeurs de vitesse volumique de
disparition de l’aspirine, notée v, en
fonction de la concentration C de l’aspirine.
Le temps t est exprimé en heures (h), la concentration C de l’aspirine
en mol·L
–1 et les valeurs de
vitesse volumique v de disparition de l’aspirine en mol·L
–1
·h
–1
.
On assimile la vitesse volumique de disparition de l’aspirine v, à une date t, à sa vitesse moyenne
de disparition entre deux dates t successives t
i et t
i+1.
10. Recopier et compléter la ligne 13 du code Python ( visant à calculer chaque valeur
de v et à l’ajouter en fin de liste v.

Grâce au code Python, on sélectionne quelques valeurs de la vitesse volumique de disparition v
de l’aspirine et on les représente en fonction de la concentration C en aspirine sur la figure
suivante.
11. Justifier, à l’aide de la figure que l’hydrolyse de l’aspirine ne suit pas une loi de
vitesse d’ordre 1 par rapport à l’aspirine dans les conditions de l’expérience.
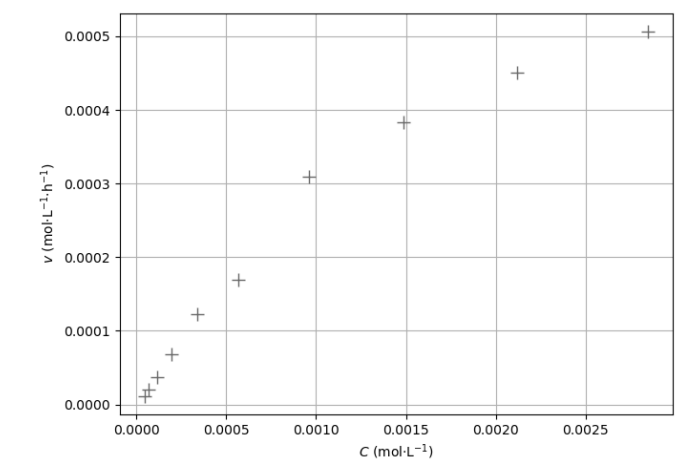
Les points ne sont pas alignés. L’hydrolyse de l’aspirine ne suit pas une loi de
vitesse d’ordre 1 par rapport à l’aspirine.
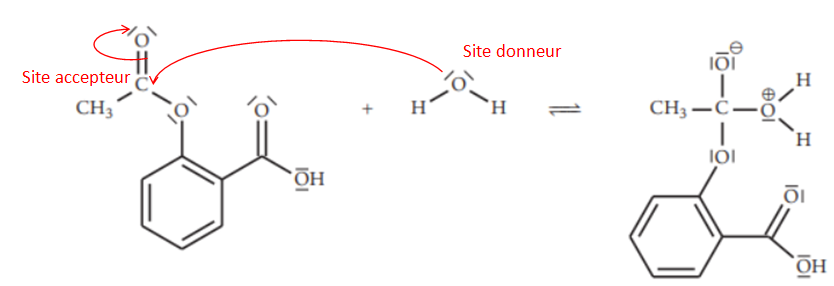
Le mécanisme réactionnel de l’hydrolyse de l’aspirine comporte plusieurs étapes.On donne la
première étape simplifiée de ce mécanisme réactionnel.
12. Entourer et nommer
le site donneur et le site accepteur de doublet d’électrons des réactifs qui interagissent lors de
cette première étape.
13. Représenter les
flèches courbes modélisant les déplacements d’électrons permettant la formation de
l’intermédiaire réactionnel.
 14.
14. Identifier, parmi les catégories suivantes, celle à laquelle appartient cette transformation :
oxydoréduction, acide-base, addition, élimination, substitution.
Réaction d'addition.
L’hydrolyse de l’aspirine est une transformation lente.
15. Proposer une modification des conditions expérimentales permettant de diminuer la durée de
cette transformation.
Augmenter la concentration de l'aspirine.
Augmenter la température.
Utiliser un catalyseur.