Exercice 1 9 points
La
frambinone, couramment appelée « cétone de la framboise », est une
molécule qui permet de retrouver l'odeur caractéristique de la
framboise. Elle est utilisée essentiellement comme arôme alimentaire.
La frambinone naturelle étant présente en très faible concentration
dans la framboise, son extraction est coûteuse et n’est pas
envisageable à l’échelle industrielle.
L’objectif de cet exercice est d’étudier dans une première partie une
des voies de synthèse de la frambinone et dans une deuxième partie le
détartrage d’une bouilloire utilisée pour préparer une infusion à la
framboise.
Les parties 1 et 2 sont indépendantes.
Partie 1. Synthèse de la frambinone
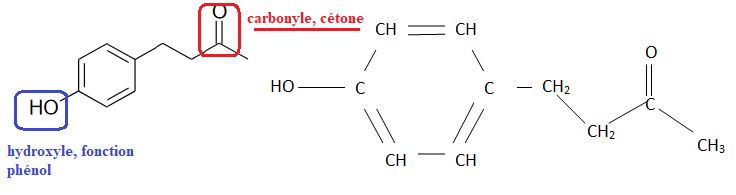
Q1. Représenter la formule semi-développée de la molécule de frambinone.
Q2. Entourer et
nommer les groupes caractéristiques de la frambinone et préciser le
groupe qui permet de justifier son appellation de « cétone de la
framboise ».
Les deux étapes de la séquence réactionnelle d’un des procédés de synthèse de la frambinone sont représentées ci-après.
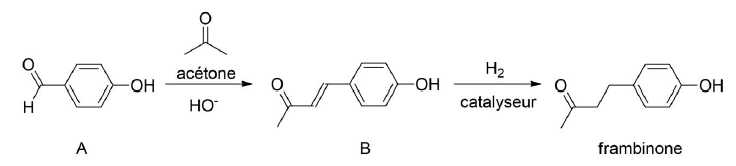 Protocole de l’étape permettant de passer de l’espèce A à l’espèce B
Protocole de l’étape permettant de passer de l’espèce A à l’espèce B (A → B)
On dissout 2,5 g de 4-hydroxybenzaldéhyde (réactif A) dans 10,0 mL d'acétone. Après dissolution,
on ajoute, en excès, 10 mL d’une solution aqueuse d’hydroxyde de sodium à 2,5 mol / L : le milieu
réactionnel prend alors une couleur ambre foncé. Après 24 h d'agitation à température ambiante, on
observe une pâte orangée. L’espèce B obtenue est un composé intermédiaire de cette synthèse.
Données :
− masse molaire du 4-hydroxybenzaldéhyde : 122,1 g / mol ;
− masse molaire de la frambinone : 164,2 g / mol1 ;
solubilité du 4-hydroxybenzaldéhyde dans différents solvants :
Solvants
|
eau
|
alcool
|
acétone
|
éther éthylique
|
solubilité
|
faible
|
forte
|
très forte
|
forte
|
L'acétone est totalement miscible à l’eau.
Q3. Justifier l’utilisation de l’acétone comme solvant lors de l’étape A → B de la synthèse.
Le 4-hydroxybenzaldehyde est très soluble dans l'acétone.
Le mécanisme réactionnel de l’étape A → B est donné.
Q4. Compléter les actes élémentaires 2 et 3 du mécanisme réactionnel en utilisant le formalisme de la flèche courbe.
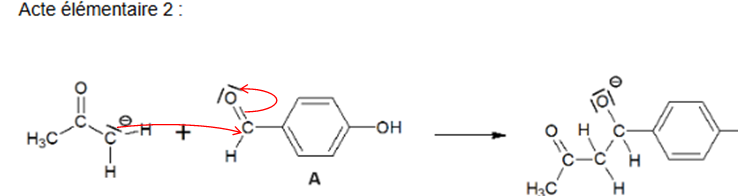
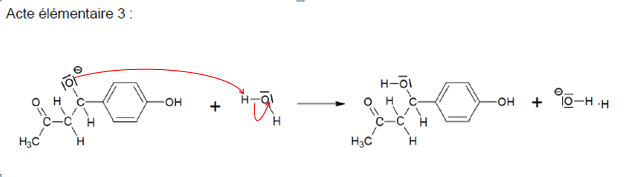 Q5.
Q5. Préciser la
catégorie de réaction (acido-basique, oxydo-réduction, élimination,
addition,substitution) de l’acte élémentaire 1 du mécanisme réactionnel.
Acido- basique.
Q6. Sachant que la
deuxième étape de la séquence réactionnelle est réalisée avec un excès
de dihydrogène et que la masse de frambinone obtenue est m
exp=2,19 g, montrer que la valeur du rendement r de la synthèse est proche de 65 %.
Réactif A : 2,5 / 122,1 =0,0205 mol.
Quantité de matière théorique de frambinone : 0,0205 mol.
Masse correspondante : 0,0205 x 164,2 =3,36 g.
rendement = masse expérimentale / masse théorique = 2,19 / 3,36=0,65 (65 %).
Partie 2 : Détartrage de la bouilloire.
La préparation de l’infusion à la framboise nécessite au préalable le détartrage de la bouilloire.
Plusieurs fabricants d’électroménager recommandent d’utiliser des
détartrants à base d’acide lactique ; en plus d’être efficace contre le
tartre, cet acide est biodégradable et non corrosif pour les pièces
métalliques des appareils électroménagers.
Étude de la solution d’acide lactique.
Données :
− formule semi-développée de l’acide lactique :
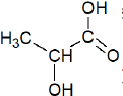
− valeur du pKA à 25°C du couple formé par l’acide lactique et l’ion lactate : 3,86 ;
− électronégativité de quelques atomes : H : 2,1 ; C : 2,5 ; O : 3,5..
Le détartrant à base d’acide lactique est conditionné sous forme
liquide dans un petit flacon de 100 mL. La notice d’utilisation indique
qu’il faut verser la totalité de son contenu dans le réservoir de la
bouilloire et qu’il faut ajouter de l’eau. On prépare ainsi une
solution aqueuse d’acide lactique de pH mesuré de valeur égale à 2,1.
Q7. Définir un acide selon Brönsted. Justifier le caractère acide de l’acide lactique.
Un acide est une espèce, ion ou molécule, susceptible de libérer un proton H
+.
L'acide lactique possède un groupe carboxyle COOH.
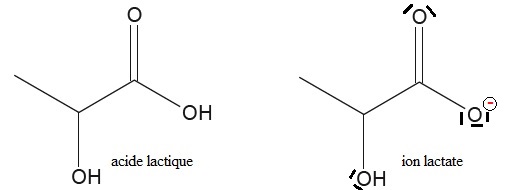
Q8. Représenter le schéma de Lewis de l’ion lactate, base conjuguée de l’acide lactique.
 Q9.
Q9. On note AH la
molécule d’acide lactique. Écrire l’équation de la réaction modélisant
la transformation chimique entre l’acide lactique et l’eau.
AH aq + H
2O (l) = A
-aq +H
3O
+aq.
Q10. Exprimer, à l’équilibre, la constante d’acidité associée à cette réaction.
Ka = [
A-aq] [H3O+aq ] / [AH aq].
Q11. À partir d’un
diagramme de prédominance, justifier que l’acide lactique prédomine
dans la solution détartrante dans la bouilloire.

A pH 2,1 inférieur à pKa, la forme AH prédomine.