A propos du phosphore 20 points.
1. Donner la composition du noyau de phosphore
3215P.
15 protons et 32-15 = 17 neutrons.
2. Enoncer les lois utilisées pour écrire une équation de désintégration.
Conservation de la charge.
Conservation du nombre de nucléons.
3. Ecrire l'équation de désintéhration ß
- du
phosphore 3215P.
3215P -->3216S +0-1e.
4. Montrer que la perte de masse est
Dm = -1,288 10
-3 u.
Dm = m(
216S) +m(
0-1e)- m(
3215P)=31,972070+0,000549-31,973907=
-1,288 10-3 u.
-1,288 10-3 x1,66 10-27= -2,138 10-30 kg.
5. Donner la relation entre l'énergie libérée et la perte de masse.
E =
Dm c
2.
6. Calculer cette énergie.
E = -2,138 10
-30 x(3,00 10
8)
2=-1,924 10
-13 J.
Cette désintégration est suivie de l'émission d'un rayonnement
g d'énergie E
g=1,71 MeV.
7. Expliquer pourquoi cette désintégration s'accompagne d'un rayonnement
g.
Le noyau fils se trouve dans un état excité ; le retour à l'état fondamental s'accompagne
d'un rayonnement g.
8. Déterminer la longueur d'onde de ce rayonnement.
Eg=1,71 MeV= 1,71 x1,6 10-13 J =2,736 10-13 J.
Eg=h c / l ; l = hc / Eg = 6,63 10-34 x3 108 / (2,736 10-13)=7,27 10-13 m.
Le sulfure d'hydrogène. 10
points.
9. Donner la configuration électronique de l'atome de soufre.
1s
2 2s
2 2p
6 3s
2 3p
4.
10. Représenter le schéma de Lewis de H
2S.
11. En déduire sa géométrie.
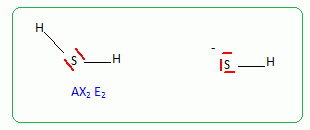
On dispose d'une solution aqueuse S
0 de sulfure d'hydrogène de concentration C
0. En y versant quelques gouttes de bleu de bromothymol, la solution devient jaune.
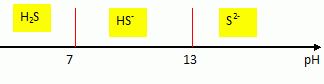
12. Conclure quant au pH de la solution.
A pH inférieur à 6,0, le bleu de bromothymol a une tente jaune.
13. Identifier l'espèce majoritaire dans S
0.
pKa1 (H
2S/HS
-)=7,0 ; pKa2(HS
-/S
2-)=13,0.
A pH inférieur à 7, H
2S prédomine.
On procède au titrage pHmétrique de V
0 = 200,0 mL de S
0 par une solution de soude de concentration C
1 = 1,0 mol / L. Seule la première acidité est dosée.
14. Ecrire l'équation support du titrage.
H
2S aq +HO
-aq --> HS
-aq + H
2O(l).
15. Déterminer les coordonnées du point d'équivamence.
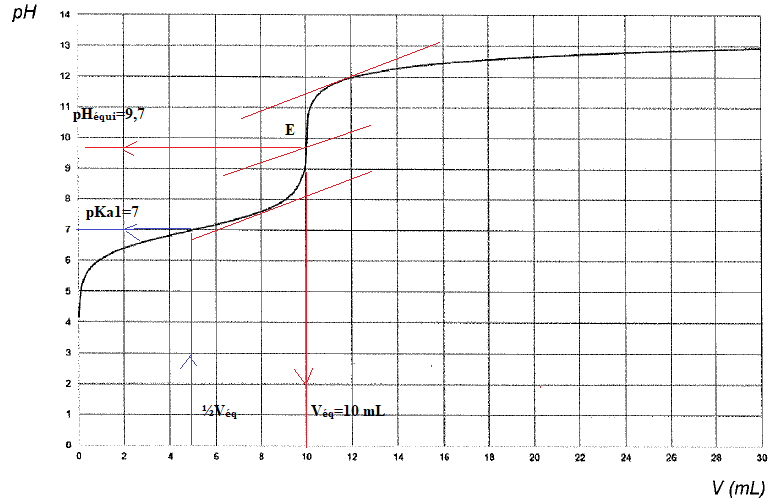 16.
16. Retrouver le pKa du couple H
2S/HS
-.
A la demi-équivalence, pH = pKa
1= 7,0.
17. Déterminer C
0.
C
0V
0 = V
éq C
1 ; C
0 =10 x1,0 /200=0,050 mol / L.