Première partie : analyse d’un comprimé
d’ibuprofène et de paracétamol.
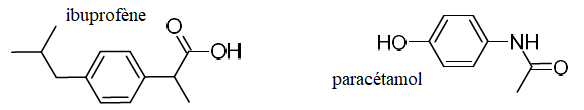
A - Analyse préalable d’un comprimé par spectroscopie infrarouge.
Il est aisé d’obtenir rapidement le spectre infrarouge d’un solide à
l’aide du dispositif ATR (Attenuated Total Reflectance) intégré au
spectromètre du laboratoire. Après réduction du comprimé en poudre, le
spectre infrarouge obtenu est le suivant :
1.
Identifier les bandes d’absorption qui témoignent de la présence
d’ibuprofène et de paracétamol dans l’échantillon analysé.
 B - Titrage du paracétamol
dans un comprimé
B - Titrage du paracétamol
dans un comprimé
Afin de vérifier la teneur en paracétamol dans un
comprimé, le technicien met en oeuvre le protocole de titrage suivant :
- dissoudre le comprimé dans 40 mL d'acide sulfurique contenus dans un
ballon ;
- ajouter quelques grains de pierre ponce puis chauffer à reflux
pendant 45 minutes ;
- refroidir la solution sous un courant d'eau froide puis verser cette
solution dans une fiole jaugée de 100 mL ;
- compléter par de l’eau distillée jusqu’au trait de jauge ;
- prélever à la pipette jaugée un volume V
PE = 10 mL de
cette solution ;
- titrer par une solution titrante de sulfate de cérium(IV), étalonnée
à C
Ce = 0,0500 mol∙L
–1, au titrateur automatique.
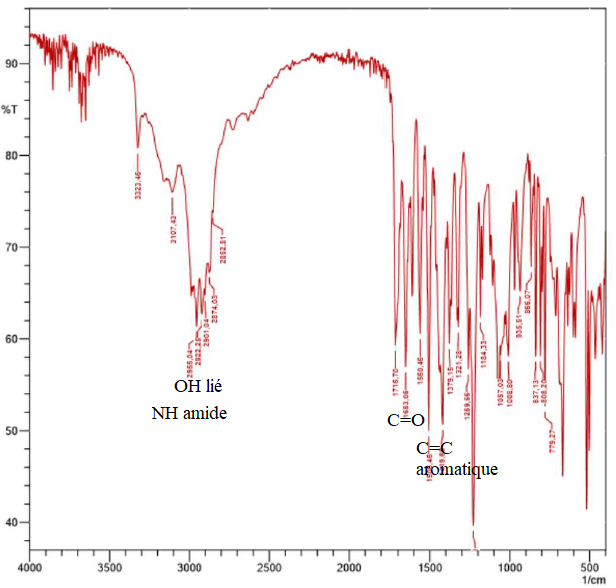
L’étape de chauffage à reflux dans la solution d’acide sulfurique
permet l’hydrolyse acide du paracétamol en para-aminophénol protoné
selon la réaction, supposée totale, d’équation :
Lors du titrage par les ions cérium(IV), le para-aminophénol protoné
est oxydé en para-benzoquinone, C
6H
4O
2,
et en ions ammonium, NH4
+. Le couple redox associé est (C
6H
4O
2
+ NH
4+)/C
6H
4(OH)NH
3+.
2. La solution
d’acide sulfurique utilisée est préparée au laboratoire en diluant par
deux la solution commerciale à 95 %. Indiquer les mentions de danger et
les pictogrammes que le technicien doit faire figurer sur la bouteille
d’acide sulfurique
ainsi préparée.

Provoque de graves brûlures de la peau et de graves lésions des yeux.
3. Écrire la
demi-équation électronique associée au couple redox du paraaminophénol
protoné puis l’équation de la réaction
support de ce titrage.
C6H4(OH)NH3++H2O
-->C6H4O2 + NH4++2H++2e-
.
2Ce4+
+2e- --> 2Ce3+.
Ajouter et simplifier :
C6H4(OH)NH3++H2O
+2Ce4+ -->C6H4O2 + NH4++2H++2Ce3+ .
4. Préciser la grandeur physique
mesurée par le titrateur et les capteurs qui permettent de suivre cette
mesure.
Titrage d'oxydoréduction : capteur
potentiométrique mesurant une tension.
Le volume relevé à l’équivalence vaut V
eq = 13,20 mL.
5. Établir, à
l’équivalence, la relation entre les quantités de matière des espèces
mises en jeu dans la réaction support de titrage puis déterminer la
valeur de la masse m de paracétamol présente dans le comprimé, avec une
incertitude élargie
relative de 2,5 % (pour un niveau de confiance voisin de 95 %).
Vérifier la conformité avec la valeur attendue.
n(
Ce4+) = 2
n(
C6H4(OH)NH3+).
Veq CCe =2 VPE C ; C
= 13,20 x0,0500 / (2x10)=0,033 mol / L.
Soit 0,0033 mol dans 100 mL ( dans un comprimé).
M(paracétamol) = 151,2 g / mol.
m=0,0033 x151,2 =0,499 g ~ 500 mg, en accord avec l'indication.
C - Dosage de
l’ibuprofène par chromatographie liquide haute performance (CLHP).
Un protocole de dosage de l’ibuprofène, par la méthode de l’étalonnage
externe, a été développé par CLHP, ce qui permet un temps réduit
d’analyse dans les conditions suivantes :
- mobile phase : phosphate buffer (pH 6,8)/ Acetonitrile (65/35, v/v)
- column : C18 (150 × 4,6 mm, 5 μm, Phenomenex Inc.)
- flow rate : 1,2 mL/min
- application : 20 μL
- run Time : 5 min
6. Préciser le type
de détecteur utilisé dans cette analyse, puis proposer un réglage
pertinent qui permet le dosage de l’ibuprofène.
L'ibuprofène
peut être détecté par chromatographie en phase gazeuse muni d'un
détecteur à ionisation de flamme ( CG/FID).
Préparation du solvant d’élution
Le solvant d’élution est un mélange de solution tampon à pH = 6,8 et
d’acétonitrile, dans un rapport volumique 65/35. Il est préparé selon
le protocole suivant :
- dissoudre dans une fiole jaugée de 1 000 mL une masse m = 1,75 g de
dihydrogénophosphate de potassium dans 900 mL d’eau ultra-pure, la
solution obtenue a un pH de 4,6. Ajuster le pH à la valeur de 6,8 ± 0,1
puis compléter la fiole au trait de jauge avec de l’eau ultra-pure ;
- mélanger cette solution tampon à de l’acétonitrile dans un rapport
volumique 65/35. Filtrer sur microfiltre 0,22 µm, puis dégazer aux
ultrasons.
7. Rédiger un
protocole d’ajustement du pH à la valeur requise. Justifier que le
solvant d’élution est bien une solution tampon. Aucun calcul n’est
demandé. On supposera que l’acétonitrile n’a aucune influence sur les
propriétés acido-basiques.
A la solution
de pH = 4,6, ajouter une solution d'hydroxyde de potassium jusqu'à
obtention de pH = 6;8, tout en agitant et mesurant le pH.
H2PO4-/HPO42-
: pKA2 = 7,2.
A pH = 6,8, on a un mélange d'un acide H2PO4-
et de sa base conjuguée HPO42-
en quantité à peu près identique : on a bien une solution tampon.
Préparation de la solution
étalon (SET) et de la gamme d’étalonnage
La solution étalon est préparée selon le protocole suivant :
- introduire une masse m1 = 20,0 mg d’ibuprofène pur dans
une fiole jaugée de 100 mL.
- compléter au trait de jauge avec le solvant d’élution.
La solution SET obtenue est utilisée pour préparer une gamme
d’étalonnage.
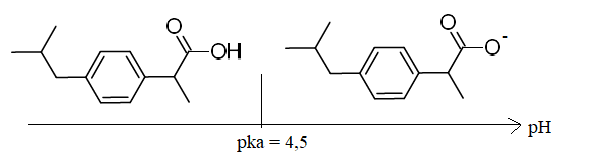
8. Indiquer, en
vous appuyant sur un diagramme de prédominance des espèces
acido-basiques, sous quelle forme se trouve l’ibuprofène dans la
solution SET.
pKa de l'ibuprofène = 4,5.
A pH =6,8 la forme base de l'ibuprofène prédomine.
9. Déterminer la
valeur de la concentration massique en ibuprofène d’une des solutions
de la gamme d’étalonnage, obtenue par dilution d’un volume V = 30,0 mL
de solution SET dans une fiole jaugée de 50,0 mL, complétée ensuite
jusqu’au trait de
jauge avec le solvant d’élution.
Facteur de dilution : 50 / 30 = 5 /3 ~1,67.
20,0 / 100 =0,20 mg / L.
0,20 / 1,67 =0,12 mg / L.
Préparation de la
fiole d’essai
La fiole d’essai est préparée selon le protocole suivant :
- peser le comprimé et noter la valeur de sa masse mCOMP ;
- broyer le comprimé finement ;
- introduire une masse d’environ m = 50 mg de la poudre obtenue dans
une fiole jaugée de 200 mL ;
- dissoudre dans le solvant d’élution ;
- compléter au trait de jauge avec le solvant d’élution.
Un technicien a fait figurer ses mesures, chromatogrammes et
exploitations des mesures sur son cahier de laboratoire :
mCOMP =0,6500 g ; m dans 200 mL : 0,0514 g.
Modélisation de l’évolution de l’aire du pic en fonction de la
concentration en masse de la solution d’ibuprofène de la gamme
d’étalonnage.
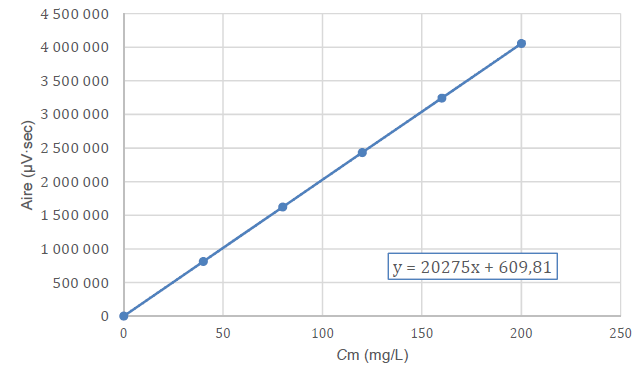 10.
10. Déduire des
résultats obtenus par le technicien la valeur de la concentration
massique en ibuprofène dans la fiole d’essai.
Aire du pic : 1 195 532 µV sec.
1 195 532
= 20275 Cm +609,81 ; Cm = 58,9 mg / L.
11. Exprimer puis
déterminer la valeur de la masse m
IBU d’ibuprofène dans le
comprimé, avec une incertitude élargie de 5 mg (pour un niveau de
confiance voisin de 95 %). Vérifier la conformité avec la valeur
attendue.
Soit 58,9 / 5=11,8 mg dans 200 mL, dans 50 mg de poudre.
mIBU=11,8
x 650 / 50 =153 ±5 mg , valeur conforme avec 150 mg.
Deuxième partie : synthèse
industrielle du méthanol
En 2015, la production mondiale de méthanol était de 100 millions de
tonnes.
Le méthanol est essentiellement utilisé comme matière première pour la
synthèse d’autres produits chimiques comme le formaldéhyde (environ 40
%) qui ensuite est transformé en produits aussi divers que des matières
plastiques, des résines, des peintures et des explosifs.
Industriellement, le méthanol est synthétisé par reformage catalytique
d’hydrocarbures, principalement du gaz naturel, suivi d’une synthèse
catalytique sous pression.
CO(g) + 2H
2(g) = CH
3OH (g)
L’étude porte sur la réaction de synthèse qui se déroule sous P =
50 bar et à T = 500 K, en présence d’un catalyseur à base de cuivre,
zinc et alumine.
12. Indiquer, en
justifiant, l’influence sur cet équilibre d’une augmentation de
pression à température constante.
Deux réactifs gazeux et un seul produit gazeux.
Principe de Lechatelier : l'équilibre se déplace dans une direction
telle qu'il s'oppose au changement. Une augmentation de pression
déplace l'équilibre dans le sens direct ( diminution du nombre de
moles).
13. Indiquer, en
justifiant, l’influence sur cet équilibre d’une augmentation de
température à pression constante.
DHr =
DfH(CH3OH)
-DfH(COH) -2DfH(H2)
= -200,7 +110,5 = -90,2 kJ / mol, réaction exothermique.
La réaction est favorisée par une diminution de température.
14. Discuter
alors des conditions opératoires industrielles choisies.
Les conditions
opératoires industrielles choisies sont en accord avec une pression
élevée et une température modérée, la température étnt un facteur cinétique.
À l’issue de ces transformations, le mélange obtenu
contient 75 % de méthanol et 25 % d’eau en masse.
Afin de séparer le méthanol du mélange, une distillation en continu de
ce mélange est effectuée à l’aide d’une colonne à garnissage
fonctionnant sous pression atmosphérique (1,013 bar).
Le mélange est introduit sous forme liquide à son point d’ébullition,
son débit A est de 2 000 kg∙h
–1. Dans le distillat, le titre
massique en méthanol est w
D = 98 % et dans le résidu, le
titre massique en méthanol w
R = 2 %.
15. Montrer que ces
conditions de fonctionnement permettent d’atteindre l’objectif de
rendement de 99 % attendu, une fois le régime stationnaire atteint.
Masse de méthanol :
dans le mélange : 2 000 x0,75 = 1500 kg.
dans le résidu : 2000 x0,02 =40 kg.
dans le distillat :
2000 x0,98 =1960 kg.
...
Le débit D’ en condensat est de 6 080 kg∙h
–1. On suppose que
la température du fluide chaud en entrée et en sortie du condenseur
reste égale à 65 °C et qu’il n’y a pas de pertes thermiques.
16. Montrer alors que la puissance thermique P
th échangée au niveau du
condenseur est de 1 897 kW.
Chaleur latente de vaporisation de la solution de méthanol de fraction massique 0,98 en méthanol à 65 °C : L
vap = 1123 kJ∙kg
–1.
1123 x 6 080 / 3600 ~1 897 kW.
17. Déterminer la valeur du débit F du fluide réfrigérant dans le
condenseur, sachant que l’eau de refroidissement y pénètre à 15 °C et
en ressort à 50 °C.
Capacité calorifique massique de l’eau liquide, considérée comme constante : C
P = 4,18 kJ∙kg
–1∙K
–1.
4,18 x(50-15) =146,3 kJ kg
-1.
146,3 / 1 897 =0,077 kg / s ou 0,077 x3600 =277 kg / h.
Le condenseur utilisé présente les caractéristiques suivantes :
- coefficient global d’échange K dans le condenseur (calculé par rapport à-surface interne des tubes) : K = 139 W∙m
–2∙K
–1
- diamètre intérieur des tubes dans le condenseur : d = 15,0 mm
- longueur des tubes : L = 2,50 m
18. Déterminer la valeur de la surface d’échange du condenseur et en déduire le nombre de tubes qu’il doit comporter.
Différence de température entre les deux liquides aux deux extrémités de l'échangeur :
extrémité 1 : 65-15 = 50 °C.
extrémité 2 :65-50=15°C.
DTm = (50-15) / ln(50 / 15) =29,07 °C.
Puissance thermique transférée entre les deux liquides : P
trans = K S
DTm .
S = Ptrans/ (K DTm)=1897 103 / (139 x29,07)=469,5 m2.
Surface d'un tube : p d L = 3,14 x15 10-3 x2,50 =0,1178 m2.
Nombre de tubes : 469,5 / 0,1178 =3985.