Chimie,
savon, mécanismes, QCM,
concours Ecole de Santé des Armées 2025.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Exercice
1. 2,5 points.
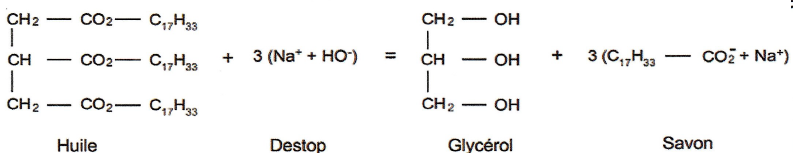
On prépare un savon de masse ms= 152 g en mélangeant de
l'huile d'olive ainsi qu'une solution commerciale de Destop assimilée à
une solution d'hydroxyde de sodium de concentration C = 5 mol / L. Msavon
= 304 g / mol.
1. Calculer la
quantité de matière de savon.
ns = ms / Msavon = 152 /304 =0,5 mol.
2. Calculer la
quantité de matière minimale nh d'huile d'olive nécessaire.
nh = ns / 3=0,5 / 3 = 1 / 6 ~0,15 mol.
3. On souhaite que le Destop soit en
excès. Quel est le volume minimal de Destop à utiliser ?.
n = ns
=0,5 mol soit 0,5 / 5 = 0,1 L ou 100 mL.
Exercice 2. 5,5
points.
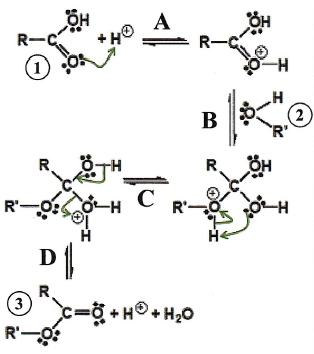
Soit le schéma de synthèse suivant.
1. Ecrire
l'équation bilan de la réaction.
R-COOH + R'OH = RCOOR' + H2O.
2. Nommer les
fonctions présentes dans les composés 1, 2, 3.
1 : acide carboxylique, fonction carboxyle.
2. fonction alcool.
3. fonction ester.
3. Etablir la
polarité de la fonction C=O dans RCOOH puis dans RCOOH2+
étape A.
Dans RCOOH : O possède un excès de charge
négatif et C un excès de charge positive.
Dans RCOOH2+
l'oxygène porte une charge positive et C une charge partielle positive.
4. Valider le formalisme
électronique de la flèche courbe et son orientation dans l'étape A.
L'atome d'oxygène possède deux doublets électroniques ( site
nucléophile) et l'ion H+ possède une charge positive (
site électrophile).
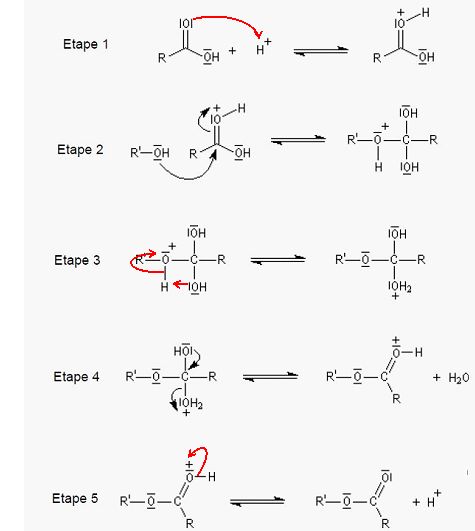
4. Réécrire l'étape B en ajoutant
uniquement deux flèches courbes afin d'expliquer la formation de
son produit.
Exercice 3. 3
points.
On donne la formule topologique de la molécule de méthacrylate de
méthyle noté MMA qui donne le plexiglass suite à sa réaction de
polymérisation.
1.
Ecrire la formule semi-développée et la formule brute du MMA.
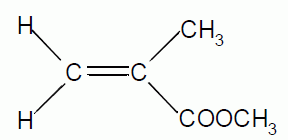
C5 H8
O2.
2.
Proposer la formule semi-développée de 2 isomères de constitution du
MMA.
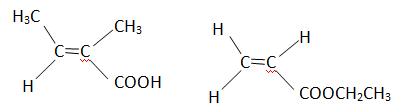
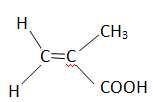
3. Le MMA a été
synthétisé à partir d'un acide carboxylique et du méthanol en
fournissant comme produit annexe de l'eau. Ecrire la formule
topologique de l'acide utilisé.
|
...
|
....
|
QCM.
9 points
.
QCM 8. Pour une solution aqueuse de pH =9 la concentration en ion H3O+ est :10-9 mol / L . Réponse A.
QCM 9. Dans la loi de Beer-Lambert le coefficient d'extinction molaire e dépend de :
la longueur d'onde, la concentration de la solution, la température. Réponses A, D, E.
QCM 10. On considère la réaction d'oxydo-réduction :
2Ag(s) + Cu2+aq --> 2Ag+aq + Cu(s).
Si [Ag+] = [Cu2+] = 0,02 mol/ L, le quotient de réaction vaut :
QR = [Ag+]2 / [Cu2+] = 0,02. Réponse A.
QCM 11. On considère les réactions ci-dessous. Indiquer le mécanisme dont résulte chacune de ces réactions.
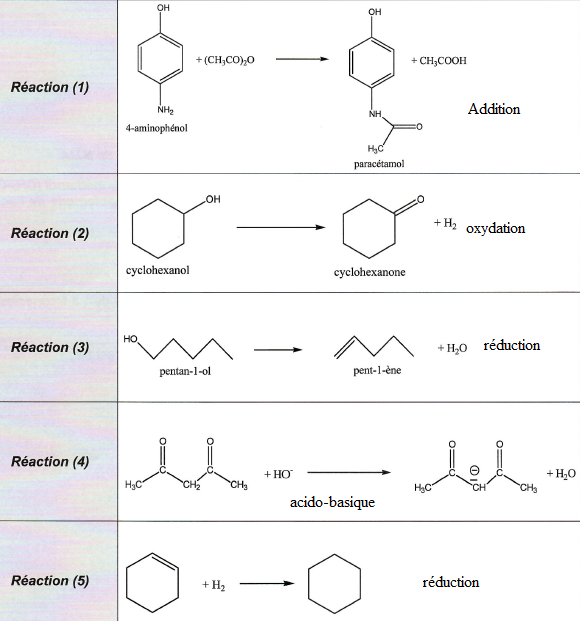
|
|
=
|
|