|
Les triglycérides : bac ST2S Polynésie 2011. |
|||||||
|
|||||||
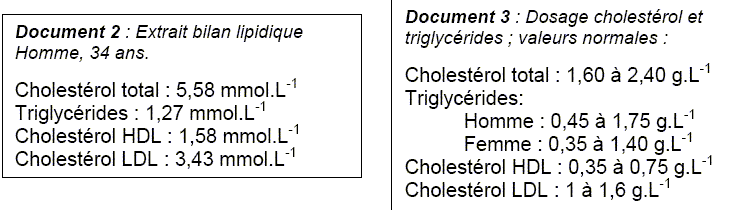 1. Bilan lipidique. A partir du document 2, indiquer la quantité de matière n de triglycérides présente dans un litre de sang du patient. Donnée : 1 mmol.L-1 = 1 x 10-3 mol.L-1 = 0,001 mol.L-1. n= 1,27 10-3 mol L-1.
1,12 g/L appartient à l'intervalle de valeurs normales [0,45 à 1,75 g/L] pour un homme. 2. Triglycérides On considère le triglycéride ci-dessous, appelé linoléine. 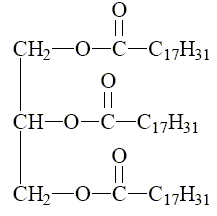 Pourquoi peut-on dire que ce triglycéride est un triester ? La linoléine possède trois groupes ester entourés en rouge ci-dessous. 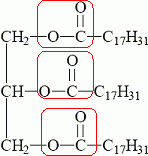 La linoléine est obtenue au cours d’une réaction dont l’équation s’écrit : 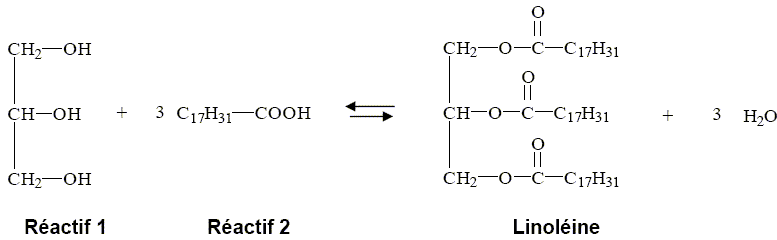 Quel est le nom donné à cette réaction ? L'action d'un alcool sur un acide carboxylique est une estérification. Nommer le réactif 1. Le glycérol ou propan-1, 2, 3-triol.
Le réactif 2, nommé acide linoléique, est-il un acide gras saturé ou insaturé ? Expliquer. La chaîne carboné compte 17 atomes de carbone. Celle-ci est saturée si elle possède 2*17+1 = 35 atomes d'hydrogène. Or elle ne possède que 31 atomes d'hydrogène : la chaîne carbonée C17H31 est insaturée. On fait réagir n2 = 1500 mol du réactif 2. A l’aide de l’équation donnée ci-dessus, indiquer quelle quantité de matière de linoléine nLinoléine pourrait être obtenue si on considérait la réaction comme totale. On obtient une mole de linoléine à partir de 3 moles duréactif 2. On obtiendra 500 moles de linoléine à partir de 1500 moles de réactif 2. Dans les mêmes conditions qu’à la question précédentes, vérifier que la masse de linoléine obtenue serait de : mLinoléine = 4,39 x 105 g Donnée : MLinoléine = 878 g.mol-1. m = n M = 500 *878 =4,39 105 g.
|
|||||||
|
|