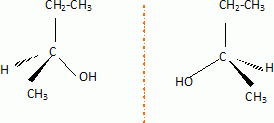|
Concours
technicien de recherche ( chimiste ) 2010 ( Avignon ) En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
On réalise une pile composée : - une lame de cuivre Cu plongeant dans 100 mL de solution aqueuse de sulfate de cuivre (Cu2+(aq) + SO42-(aq)) de concentration molaire apportée C1= 0,50 mol.L-1 ; - une lame d’argent Ag plongeant dans 100 mL de solution aqueuse de nitrate d’argent (Ag+(aq) + NO3-(aq)) de concentration molaire apportée C2= 0,10 mol.L-1 ; Les deux demi-piles sont reliées par un pont salin de nitrate de potassium. La pile est branchée aux bornes d’un conducteur ohmique. Un ampèremètre indique que le courant circule de l’électrode d’argent vers l’électrode de cuivre. Faire un schéma de la pile en précisant notamment : la polarité des électrodes ; le sens du courant ; le sens de circulation des électrons. 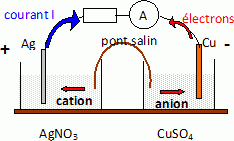 Donner son schéma conventionnel. - Cu(s) / Cu2+aq // Ag+aq / Ag (s) + Écrire les équations des réactions qui se produisent aux électrodes. Calculer le potentiel de chaque demi-réaction. Oxydation du cuivre à l'anode négative : Cu(s) = Cu2+aq + 2e-. E1 = E°( Cu2+aq/ Cu(s)) + 0,03 log [Cu2+aq] = 0,34 + 0,03 log 0,50 = 0,33 V. Réduction des ions argent à la cathode positive : Ag+aq +e- = Ag(s) E2 = E°( Ag+aq/ Ag(s)) + 0,03 log [Ag+aq] = 0,80 + 0,06 log 0,10 = 0,74 V. Donner l’équation globale de fonctionnement de la pile. Calculer la force électromotrice de cette pile. Cu(s) +2 Ag+aq = Cu2+aq +2Ag(s) E = E2 -E1 =0,74-0,33 = 0,41 V.
Calculer la valeur du quotient de réaction Qr i initial associé à l’équation précédente. Le sens d’évolution du système satisfait-il aux critères d’évolution spontanée ? Oui : Qr i < K, le système évolue spontanément dans le sens direct. La concentration molaire effective en ions métalliques de chaque demi-pile varie-t-elle ? Si oui, dans quel sens ? Les ions argent sont consommés, leur concentration diminue. Des ions cuivre (II) sont formés, leur concentration augmente. Comment est assurée l’électroneutralité de chaque solution au cours du fonctionnement de la pile ? La migration des ions du pont salin assure l'électroneutralité des solutions : Migration des ions K+aq dans la solution de nitrate d'argent pour compensé la disparition progressive des ions argent. Migration des ions nitrate dans la solution de sulfate de cuivre, dans laquelle la concentration des ions cuivre (II) augmente. Lorsque la pile cesse de fonctionner, on peut considérer que tous les ions argent (I) ont été consommés. Calculer la quantité d’électricité maximale que peut fournir cette pile. Quantité de matière initiale d'ion argent : n(Ag+aq ) = C2V = 0,10*0,10 = 0,01 mol. Quantité de matière d'électrons : n(e- ) =n(Ag+aq ) =0,01 mol. Quantité d'électricité : Q = 96500n(e- ) = 96500*0,01 = 965 C. L’intensité mesurée par l’ampèremètre a pour valeur I = 2 mA. Pendant combien de temps la pile peut-elle fonctionner dans ces conditions ? Q = It ; t = Q/I = 965 / 2 10-3 =4,8 105 s. Déterminer, à l’aide d’un tableau d’avancement, la quantité d’ions cuivre (II) présents lorsque la pile cesse de fonctionner, et calculer leur concentration.
0,01-2xmax =0 ; xmax =0,005 ; n = 0,05+0,005 = 0,055 mol dans V = 0,10 L [Cu2+aq]fin =0,055 / 0,1 = 0,55 mol/L.
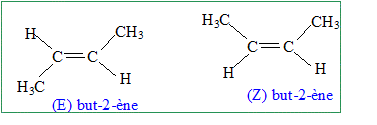
On effectue, dans du dioxygène, la combustion complète de 1,12 g d’un hydrocarbure X, non cyclique, de formule brute CxHy (masse molaire 56 g.mol-1). On obtient 3,52 g de dioxyde de carbone (masse molaire : 44 g.mol-1) et 1,44 g d’eau (masse molaire : 18 g.mol-1). Quelle est la formule brute de cet hydrocarbure X ? CxHy + (x+0,25y)O2 = x CO2 + 0,5 yH2O. Quantité de matière d'hydrocarbure : n = m/M = 1,12 / 56 =0,02 mol Quantité de matière de dioxyde de carbone : 3,52 / 44 = 0,08 mol Par conséquence x = 4. Quantité de matière d'eau : 1,44 / 18 = 0,08 mol. Par conséquent 0,5 y = 4 ; y = 8. C4H8. Donner la formule développée de tous les isomères de X et préciser le nom du composé X sachant qu’il présente une isomérie Z/E. Représenter ces isomères Z et E. CH3-CH2-CH=CH2, but-1-ène.
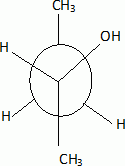
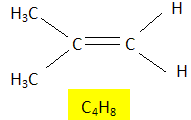 2-méthylpropène 2-méthylpropènePar hydratation, on obtient à partir de X un alcool secondaire A. Donner sa formule semi-développée et son nom. 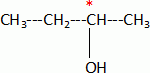 butan-2-ol. butan-2-ol.
|
|||||||||||||||||||||||||||
| |
|||||||||||||||||||||||||||
|
|