|
Concours ESSA Lyon 2010 : cinétique et catalyse chimique. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
« Que ton aliment soit ta seule médecine » Hippocrate (-460 ;-370 av J-C) Le rôle des aliments est important dans la protection de notre organisme, notamment contre la production de radicaux libres (espèces nocives hautement réactives) à partir du peroxyde d’hydrogène (nommé commercialement eau oxygénée). La catalase : une prévention contre les radicaux libres : La
catalase est une enzyme catalysant la réaction de décomposition de
l’eau oxygénée dans l’organisme, empêchant alors la production de
radicaux libres. Le mécanisme supposé est le suivant :
Décomposition de l’eau oxygénée par les ions iodures : H2O2(aq) + 2H+(aq) + 2I-(aq) = 2H2O(l) + I2(aq) Pour chacun des trois mélanges, on suit la concentration du diiode formé par spectrophotométrie ; les courbes cinétiques obtenues sont représentées ci-dessous par les courbes 1 à 3 (dans le désordre) 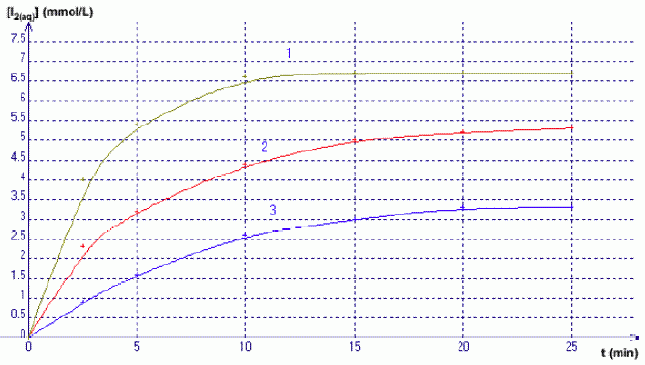 Donner la définition d’oxydant. Donner la définition d’une réduction. Qui de l’oxydant ou du réducteur subit une réduction ? Un oxydant est une espèce susceptible de gagner un ou plusieurs électrons. Lors d'une réduction, l'oxydant gagne un ou plusieurs électrons : l'oxydant se réduit. Identifier dans chaque couple mis en jeu l’oxydant et le réducteur. H2O2 : oxydant, il se réduit ; I- : réducteur, il s'oxyde. Rappeler l’expression de la loi de Beer-Lambert liant absorbance et concentration. Préciser les unités de chacun des termes. La loi de Berr-Lambert exprime la variation de l'intensité lumineuse en fonction de la distance parcourue dans un milieu transparent. Lorsqu'une lumière monochromatique d'intensité I0 traverse un milieu homogène, l'intensité de la lumière émergente I décroît exponentiellement lorsque l'épaisseur l du milieu absorbant augmente. I = I0 . e (- al) a est une constante appelée coefficient d'absorption, caractéristique du milieu et de la longueur d'onde considérés. Dans le cas des solutions, la loi de Beer fait intervenir les concentrations. I = I0 . e (- elc) où e est un coefficient caractéristique de la substance appelé coefficient d'absorbance (L mol-1 cm-1), l est l'épaisseur de la cuve (cm) et c la concentration de la solution (mol/L). Cette loi est vérifiée lorsque la solution est de concentration inférieure à : c < 0,1 mol.L-1. La relation fondamentale utilisée en spectrophotométrie est présentée sous la forme : A= log (I0/I) = elc ( A est l'absorbance ou densité optique) e est une caractéristique de la molécule. Plus e sera grand, plus la solution absorbe.
La courbe (3) indique [I2] = 1 mmol/L à t = 3 min. En déduire la valeur de l’absorbance A à 3 minutes sachant que ε = 1,878.103 L.mol-1.cm-1 et l = 1 cm. A = elc = 1,878 103 *1*10-3 =1,878 ~2. Définir le temps de demi-réaction t½. Le temps de demi-réaction est la durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final xf. A l’aide du graphique, en déduire sa valeur (à la minute prés) pour le mélange représenté par la courbe (3). 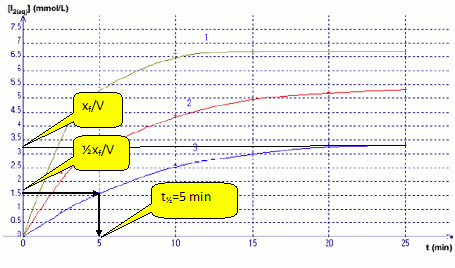 On considère le mélange C. Le tableau ci-dessous représente le tableau d’avancement incomplet de la réaction (on note x la valeur de l’avancement à l’instant t et xmax sa valeur à tmax) Quelles sont les valeurs que vous devez attribuer aux lettres a, b et c ?
Si I-(aq) est en défaut : 0,1 10-2-xmax =0 ; xmax = 0,1 10-2mol Retenir la plus petite valeur. Répondre à ce questionnaire à choix multiple (de 0 à 5 réponses justes possibles) : a) Dans le mélange C, le réactif limitant n’est pas l’ion iodure I-. Vrai. b) De la valeur de c, on déduit que la courbe 3 correspond au mélange C.Vrai. Mélange C : [I2] = 10-4 / 30 10-3 =0,1 / 30 mol/L = 100 / 30 mmol/L =3,3 mmol/L c) A t=5 min, la valeur de V3 est supérieure à celle de V1. Faux. (on note V1 et V3 respectivement les vitesses volumiques de réaction pour les courbes 1 et 3) 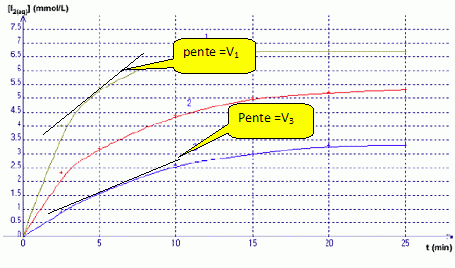 La vitesse est égale à la pente des tangentes aux courbes à la date t = 5 min. A la tangente la plus inclinée par rapport à l'horizontale, correspond la plus grande vitesse. d) Sachant que la courbe 1 correspond au mélange A et que la courbe 2 correspond au mélange B, on peut affirmer que la courbe 2 atteindra la même limite que la courbe 1. Vrai. Dans les deux cas le peroxyde d'hydrogène est égal à n = 2 10-4 mol et constitue le réactif limitant.
|
|||||||||||||||||||||||||||||||||||||||||||||||
| |
|||||||||||||||||||||||||||||||||||||||||||||||
|
|