|
Concours
assistant d'ingénieurs : techniques d'analyse chimique 2010
( Reims ) D-xylose : configuration, dosage en retour, pouvoir rotatoire, anomère, RMN xylitol. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|||||||
| .
. |
|||||||
|
|||||||
|
Le xylitol est un édulcorant obtenu par réduction du D-xylose, sucre issu de l'hydrolyse d'hémicelluloses contenues dans les parois des végétaux ( écorces de bois, paille...). Cette étape de réduction se fait industriellement par hydrogénation catalytique, mais peut être effectuée par des microorganismes ( levures ). précisez la configuration absolue des carbones asymétriques du D-xylose. 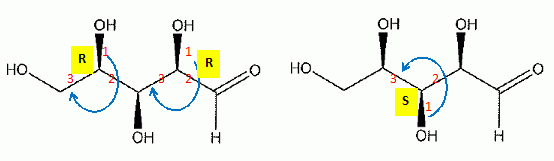 Donner la représentation de Fisher du D-xylose. Que signifie le D de D-xylose ? D signifie dextrogyre. 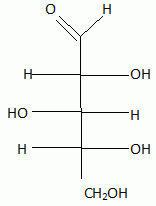 Donner la structure du xylitol. Ce composé est-il optiquement actif ? 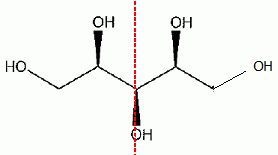 Ce composé possède un plan de symétrie passant par le carbone 3 : il n'est pas optiquement actif.
Proposer une autre méthode de réduction du D-xylose, réalisable au laboratoire. Couple : C5H9O6 - / C5H10O5. C5H10O5 + 3HO- = C5H9O6 - +2H2O +2e- ( oxydation ) Couple I2 / I- : I2 + 2e- = 2 I- ( réduction ). Bilan : C5H10O5 + 3HO- + I2 = C5H9O6 - +2H2O + 2 I-. (1) Donnez les demi-équations des couples suivants : I2 / I- et S4O62- / S2O32-. Donnez l'équation bilan. I2 + 2e- = 2 I- ( réduction ) ; 2 S2O32-= S4O62- + 2e- ( oxydation ). Bilan : 2 S2O32- + I2 = S4O62- + 2 I-. Utilisez vous un indicateur coloré ? Si oui, lequel ? Oui : l'empois d'amidon donne en présence de diiode une couleur violet très foncée. Expérience : sont introduits dans un erlenmeyer : 20 mL d'une solution de diiode [I2] =5,0 10-2 mol/L + 2 mL d'une solution d'hydroxyde de sodium [NaOH] =2,5 mol/L et 10 mL de la solution S1. Cette solution est laissée à l'abri de la lumière durant 30 min. Après ce laps de temps, celle-ci est remise à la lumière et on introduit 7 mL d'acide chlorhydrique 1,0 mol/L. La solution est alors dosée par une solution de thiosulfate [S2O32-] =0,10 mol/L. On obtient un volume équivalent V1 =16,0 mL. En déduire la concentration ( g / mL) en D-xylose du sirop. Qunatité de matière de diiode : - initiale : 5,0 10-2 * 20 10-3 =1,0 10-3 mol. - en excès : ½n(S2O32-) = ½ [S2O32-]V1 =0,5*0,10*16 10-3 =0,80 10-3 mol. - ayant oxydé le D-xytlose : 1,0 10-3 - 0,80 10-3 = 0,20 10-3 mol . (1) donne n(D-xylose) = 0,20 10-3 mol dans 10 mL de la solution S1. [D-xylose] =0,20 10-3 /0,010 =0,020 mol /L dans S1. Tenir compte de la dilution au 1/20 : concentration du D-xylose dans le sirop : 0,40 mol/L M(D-xylose) =5*12+10+5*16 =150 g/mol. Concentration du D-xylose dans le sirop : 150 *0,20 = 60 g/L ou 0,060 g / mL ou 60 kg m-3. Quel est le rôle de l'ajout d'acide chlorhydrique 1,0 mol/L ? Faire apparaître tout le diiode ( une partie se trouvant sous forme de IO3- en milieu basique ). Comment qualifie t-on ce type de dosage ? Dosage en retour ou dosage par différence.
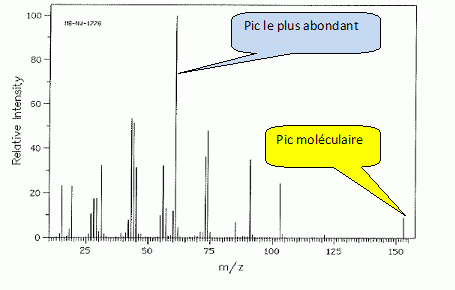
Quelle valeur obtenez-vous en mesurant le pouvoir rotatoire spécifique du sirop de D-xylose à l'aide d'un polarimètre ? On donne [a]D20 =+20,0 ( c =10, H2O) ; longueur de la cuve : 10 cm. a = [a]D20.C.L. a (°) angle de rotation du plan de vibration des ondes lumineuses ; [a]D20 : pouvoir rotatoire spécifique ( ° m2 kg-1 ) C: concentration ( kg m-3 ) ; L: longueur (m) de cuve. a = 20 *60 *0,1 =120°. Un test à la liqueur de Fehling permet de suivre la réaction de réduction : l'ajout de Cu2+ en milieu basique permet de mettre en évidence la présence de sucres réducteurs. Qu'appelle t-on sucre réducteur ? Un sucre réducteur possède une fonction aldehyde. Qu'observe t-on en présence d'un sucre réducteur ? Un précipité rouge brique de Cu2O(s). Donner l'équation bilan correspondante. ( dans le cas du glucose). couple redox : C6H11O7- / C6H12O6. C6H12O6 +3HO- = C6H11O7- + 2e- +2H2O (1) oxydation couple redox : CuT22- / Cu2O(s) 2CuT22-+ 2e- +2HO- = Cu2O(s)+ 4T2- +H2O (2) réduction C6H12O6 +5HO- +2CuT22-= C6H11O7- +Cu2O(s)+ 4T2- +3H2O. En solution, le D-xylose existe sous forme d'un mélange de deux formes cyliques ( anomères a et ß ). Quelle type de réaction conduit à la formation de ces deux cycles ? Les représenter. Formation d'un hémiacétal cyclique. 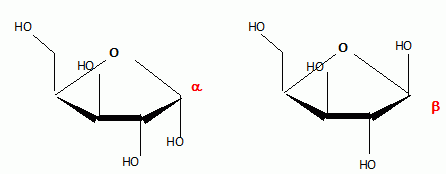 Le spectre RMN13C du xylitol en solution dans D2O est donné. 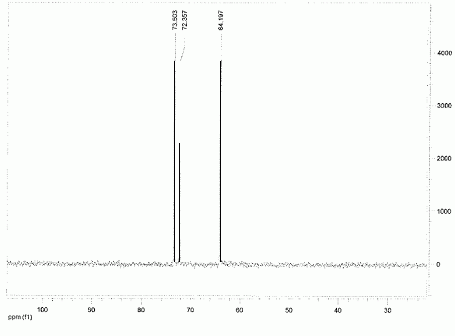 Combien de pics observez-vous ? Combien de carbones comporte le xylitol ? Justifier. On observe 3 pics ; le xylitol compte 5 carbones. Du fait de l'existence d'un plan de symétrie, les carbones 1 et 5 sont équivalents, de même pour les carbones 2 et 4.
|
|||||||
| |
|||||||
|
|