|
Concours
assistant d'ingénieurs : techniques d'analyse chimique 2010
( Reims ) Autour de l'élément aluminium, l'eau de Javel. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|||||||
| .
. |
|||||||
|
|||||||
|
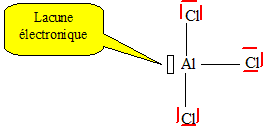
Laluminium a pour numéro atomique Z = 13. Donner la structure électronique de l'atome d'aluminium dans l'état fondamental. 1s2 2s2 2p6 3s2 3p1. Quel est l'ion le plus probable ? Justifier. En perdant tois électrons, on obtient l'ion Al3+ dont la couche électronique externe est saturée à 8 électrons. ( 1s2 2s2 2p6 ) On plonge un morceau de feuille d'aluminium préalablement chauffé dans un ballon contenant du dichlore, Cl2. Le métal s'enflamme et il se forme une fumée blanche de chlorure d'aluminium, AlCl3. Ecrire l'équation bilan de la réaction. Quelle propriété de l'aluminium met-on en évidence ? Comment évolue t-elle dans une ligne de la classification périodique ? Donner la structure de Lewis de AlCl3. 3Cl2(g) + 2 Al(s) = 2 AlCl3. L'aluminium est un métal réducteur. Ce caractère métallique réducteur diminue quand on se déplace da gauche à droite dans un même ligne de la classification périodique.
Le précipité d'hydroxyde d'aluminium Al(OH)3 est un hydroxyde amphotère peu soluble qui se dissocie suivant les réactions : Al(OH)3 + 3H3O+ = Al3+ +6H2O en milieu acide (1). Al(OH)3 +HO- =[Al(OH)4]- en milieu basique (2) On donne : Al(OH)3 (s) = Al3+ + 3HO- : pKs = 32,5 ; Al3+ + 4HO- =[Al(OH)4]- : log K = 33,4. Calculer littérallement et numériquement les constantes d'équilibre de ces deux réactions en fonction des données. Ks = [Al3+][HO-]3 =3,16 10-33. K1 = [Al3+] / [H3O+]3 =[Al3+][HO-]3 / ([H3O+]3[HO-]3)=Ks / Ke3 =3,16 10-33 / (10-14)3 =3,16 109. K =[ [Al(OH)4]-] / ([Al3+][HO-]4) ; K2 = [ [Al(OH)4]-] / [HO-]=[ [Al(OH)4]-] [Al3+][HO-]3/([Al3+][HO-]4) = K Ks = 1033,4 *3,16 10-33 =7,94.
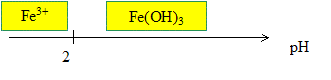
Calculer le pH ( pH1) de début de précipitation pour une concentration en élément aluminium C =1,00 10-2 mol/L en négligeant la présence de l'ion Al3+. Vérifier ensuite cette hypothèse en évaluant leur concentration. K2 = [ [Al(OH)4]-] / [HO-] ; [HO-] = [ [Al(OH)4]-] / K2 = 0,0100 / 7,94 =1,26 10-3 mol/L. [H3O+] =Ke / [HO-]=10-14 /1,26 10-3 =7,94 10-12 mol/L pH2 = - log 7,94 10-12 =11,1. Ks = [Al3+][HO-]3 ; [Al3+] =Ks / [HO-]3 = 3,16 10-33/ (1,26 10-3)3 =1,58 10-24 mol/L. En déduire le diagramme de prédominance des espèces aluminium (III° en fonction du pH.  De même, l’hydroxyde de fer(III) est un sel
peu soluble qui se dissocie selon :
Pour rester dans le domaine de précipitation du fer (III), on doit réaliser une solurion tampon. Calculer le volume V d'une solution d'éthanoate de sodium à 1,00 mol/L à verser dans un volume V0 =500 mL de solution d'acide éthanoïque à 0,500 mol/L pour obtenir une solution tampon à pH=4,5. On donne Ka( CH3COOH / CH3-COO-) = 1,7 10-5. pKa =4,77. pH = pKa + log ([CH3-COO-] / [CH3COOH]) ; log ([CH3-COO-] / [CH3COOH]) = 4,5-4,77 = -0,27. [CH3-COO-] / [CH3COOH] = 0,537. [CH3COOH] = 0,500 V0 / (V0+V) ; [CH3-COO-] = 1,00 V / (V0+V) ; [CH3-COO-] / [CH3COOH] =V / 0,500 V0 = V / 0,25 = 4 V. 4 V = 0,537 ; V = 0,134 l = 134 mL. Selon le procédé de BAYER mis au point en 1887, la bauxite, une fois broyée, est mélangée à de la soude à haute température et sous pression de 20 bar. La liqueur obtenue, l'aluminate de sodium, AlO2Na, est débarrassée de ses impuretés, puis diluée et refroidie, ce qui provoque la précipitation d'oxyde d'aluminium hydraté, Al(OH)3. Pour interpréter les phénomènes, nous rappelons que Al2O3 est équivalent à Al(OH)3 ou Al2O3, 3H2O, que Fe2O3 est équivalent à Fe(OH)3 ou Fe2O3, 3H2O, et AlO2Na est équivalent à Al(OH)4 Na ou AlO2Na, 2H2O. La silice ne réagit pas avec la soude. Ecrire la réaction de la soude, NaOH sur l’alumine Al2O3 et qui donne l'aluminate de sodium, AlO2Na. Al2O3 +2 NaOH = 2 AlO2Na +H2O. Justifier à l’aide des questions précédentes que l’on puisse séparer l’aluminium par cette méthode. A pH>11,1, l'aluminium se trouve sous forme d'ion [Al(OH)4]- en solution ; les autres espèces ioniques sont précipitées sous forme d'hydroxydes solides. Justifier qualitativement que la dilution favorise la formation de l’hydroxyde. En diluant une solution basique ( pH>11,1) , la concentration en ion hydroxyde diminue : la concentration en ion oxonium augmente et le pH diminue. Dés que le pH devient inférieur à 11,1, l'hydroxyde Al(OH)3 précipite.
Problème 7. L'eau de Javel est une solution aqueuse équimolaire d'hypochlorite de sodium ( Na+aq + ClO-aq) et de chlorure de sodium ( Na+aq+ Cl-aq). La concentration des eaux de Javel est exprimée par la teneur en chlore actif sous la forme d'un pourcentage pondéral. Ce pourcentage correspond à la masse, exprimée en gramme de dichlore Cl2(g) nécessaire pour préparer 100 g de solution, selon l'équation : Cl2(g)+2HO-aq = ClO-aq +Cl-aq +H2O(l). La terminologie "eau de Javel" est réservée aux solutions vendues dans le commerce dont la teneur en chlore actif est inférieure à 10 %. Pour les teneurs plus élevées, dans l'industrie, on utilise la dénomination " hypochlorite de sodium". Quels types de renseignements sont données dans les phrases R et S d'une fiche toxicologique ? R : risques encourus ; S : mesures de sécurité, précautions à prendre. Quel(s) est (sont) le(s) pictogramme(s) devant être trouvé(s) pour une solution d'hypochlorite à 25 % ?  Corrosif ; danger pour l'environnement ; nocif, irritant. Quel(s) est (sont) le(s) pictogramme(s) devant être trouvé(s) pour une solution d'eau de Javel à 9,6 % ?  nocif, irritant. nocif, irritant.L'ajout d'acide chlorhydrique à une solution d'eau de Javel provoque un dégagement de dichlore gazeux. On désigne le degré chlorométrique d'une solution concentrée d'eau de Javel comme le volume, exprimé en litre de dichlore gazeux qui peut être libéré par l'addition d'acide chlorhydrique en quantité non limitante à un litre d'eau de Javel dans les conditions normales de température et de pression. On cherche la correspondance entre le degré chlorométrique et le pourcentage en chlore actif d'une solution commerciale d'eau de Javel à 9,6 %. Quelle est la concentration en ion hypochlorite de la solution commerciale ? On donne sa densité d = 1,158. 9,6 g de dichlore pour préparer 100 g de solution commerciale soit 100 / 1,158 = 86,36 mL Quantité de matière de dichlore : n = m / M = 9,6 / 71 =0,1352 mol. Quantité de matière d'ion ClO-aq : n = 0,1352 mol dans 86,36 mL ; [0,1352 mol] = 0,1352 / 0,08636 =1,57 mol/L. Ecrire l'équation bilan de la réaction entre une eau de Javel et une solution d'acide chorhydrique. Indiquer les couples oxydant / réducteur. Couple ClO- aq /Cl2 (g) : 2ClO- aq +4H+aq + 2e- =Cl2 (g) + 2H2O(l) ; réduction. Couple Cl2 (g) / Cl- aq : 2 Cl- aq = Cl2 (g) +2e- : oydation. 2ClO- aq +4H+aq + 2 Cl- aq =2Cl2 (g) + 2H2O(l). Calculer le degré chlorométrique de la solution commerciale. Volume de dichlore gazeux ( CNTP) : V = n Vm = 0,1352 *22,4 =3,029 L à partir de 86,36 mL de solution. Soit pour 1 L de solution : 3,029*1000 / 86,36 =35,1 degrés chlorométrique.
|
|||||||
| |
|||||||
|
|

 . On veut procéder à son extraction.
. On veut procéder à son extraction.