|
Dosage des ions nickel(II) par l'EDTA : concours Agrégation interne 2011. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
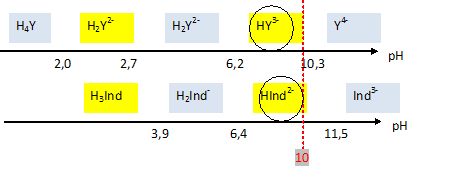
L'acide éthylène diammine tétracétique noté YH4 est un tétraacide, dont la tétrabase Y4- peut former un complexe [NiY]2- avec l'ion Ni2+. On peut envisager un dosage des ions Ni2+ selon le protocole suivant :
En déduire l'équation de la réaction de dosage et calculer sa constante d'équilibre. L'excès d'EDTA est complexé par les ions Mg2+. Mg2+ + HY3- +NH3 = [MgY]2-+ NH4+. K' = [[MgY]2-] [NH4+] / ([NH3] [HY3-] [Mg2+]) = ßMg Ka4 /Ka = 5,0 108 *5,0 10-11 / (6,3 10-10) ~4,0 107. Indiquer le changement de couleur observé à l'équivalence et préciser s'il convient de repérer le début ou la fin du virage de l'indicateur pour pouvoir en déduire la concentration CNi. Avant l'équivalence le NET est sous forme HInd2- : bleu. ( [MgIndY]- est moins stable que [MgY]2- ). Juste après l'équivalence, l'ion Mg2+ est en excès. Ces derniers forment avec le NET un complexe de couleur rouge foncé. Il faut repérer l'équivalence au début du changement de teinte. Le volume de titrant versé est VE = 6,0 mL. En déduire CNi. A l'équivalence : n(EDTA) excès =VE CMg =6,0*1,00 10-2 =6,0 10-2 mmol. n(EDTA) initial =VY CY =30,0*1,00 10-2 =30,0 10-2 mmol. n(Ni2+) =n(EDTA) initial -n(EDTA) excès =24 10-2 mmol. CNi = 24 10-2 / VNi =24 10-2 / 20 =1,2 10-2 mol/L. Expliquer pourquoi le titrage ne pouvait pas être réalisé en utilisant un tampon à pH=5 ou à pH = 12. A pH=5 la forme de l'indicateur coloré est rouge, comme la teinte du complexe [MgIndY]- . A pH=12 la forme de l'indicateur coloré est orange, couleur proche la teinte du complexe [MgIndY]- .
Un élève observe les indications inscrites sur la burette graduée : 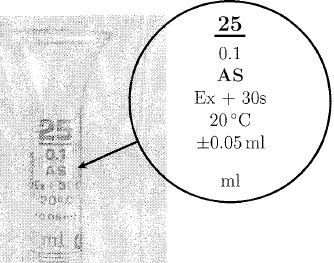 Indiquer les informations à lui donner pour expliciter clairement ces indications. Burette graduée au dixième de mL entre 0 à 25 mL. "Ex" signifie extérieur ; "AS" signifie burette de grande précision ; la burette est jaugée à 20°C. Le volume est lu à plus ou moins 0,05 mL. Il faut attendre 30 s avant de faire une lecture. Préciser les consignes à fournir à des élèves lorsqu'ils utilisent la burette graduée. Fixer verticalement la burette sur son support et placer un becher en dessous. Effectuer un premier rinçage avec de l'eau distillée puis avec la solution titrante, robinet ouvert. Vérifier le bon fonctionnement du robinet. Remplir en partie la burette avec la solution titrante, ouvrir le robinet, laisser la solution s'écouler afin que la partie inférieure au robinet soit remplie sans bules d'air, fermer alors le robinet. Remplir la burette au dessus du zéro, ajuster au zéro et vérifier qu'il n'y ait pas de bulles d'air dans la burette. Quel est l'intérêt de la bande photophore ? Lecture plus commode du volume : on observe un resserement au niveau de la surface libre du liquide. Un professeur fait réaliser à ses élèves de terminale le dosage direct d'un volume V0 d'une solution d'ion magnésium de concentration C0 par une solution de Na2H2Y de concentration CY = 1,00 10-2 mol/L. L'équivalence est repérée par le virage du NET. Le professeur décide d'effectuer un traitement statistique de l'ensemble des résultats du groupe de TP. Il demande à chaque binôme de venir donner le volume V0 prélevé en précisant l'instrument utilisé pour le prélevement, le type de burette utilisé, le volume relevé à l'équivalence et la valeur calculée pour la concentration en ion magnésium de la solution titrée.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||