|
|
|
|
Physique.
Un fil cylindrique a un diamètre de d =3 mm et une longueur L=50 cm.
Calculer
sa section ( cm2) et son volume ( cm3).
S = p d2/4 = 3,14
*0,32 / 4 =7,069 10-2 ~7,1 10-2 cm2.
V = S L = 7,069 10-2
*50 =3,534 ~3,5 cm3.
Calculer
sa masse sachant qu'il s'agit d'un alliage cuivre-or de masse
volumique r = 17,25 g cm-3.
m = r V = 17,25 *3,534
=60,967 ~61 g.
On utilise ce
fil comme résistance R, calculer sa valeur.
Résistivité du cuivre = 2 10-8 W m.
R = résistivité L / S = 2 10-8 *0,50 / (7,069 10-6) =1,4 10-3
W.
Donner
le nom et le type de grandeur des symboles suivants.
A : ( ampère)
intensité du courant ; V : (
volt) tension électrique.
Pa : ( pascal )
pression ; W : ( watt )
puissance.
W
: ( ohm ) résistance électrique ; S
: ( siemens ) conductivité électrique.
Le thermomètre indique 30 °C, donner la température
thermodynamique en kelvin.
T = 30 + 273 = 303 K.
4 résistances de 100 ohms
son en série, donner la résistance totale du montage.
4*100 = 400 ohms.
4 résistances de 100 ohms
son en parallèle, donner la résistance totale du montage.
100 / 4 =
25 ohms.
Une
bouteille de gaz contient du dioxygène, son volume est V = 150 L, sa
pression initiale est P = 120 bars à température de 20 °C.
Calculer
la masse d'oxygène contenue dans la bouteille.
P = 1,20 107 Pa ; T = 20+273 = 293 K ; V = 0,150 m3.
Quantité de matière de dioxygène : n = PV / (RT) = 1,20
107 *0,150 / (8,314*293) =739 mol.
Masse de gaz : m = n M(O2) =739*32 =2,36 104 g =
23,6 kg.
On
expose cette bouteille au soleil et la température avoisine 50 °C. Quelle est la
nouvelle pression P' ?
P' = P T ' / T = 120 *(273+50) / 293 = 142 bars.
|
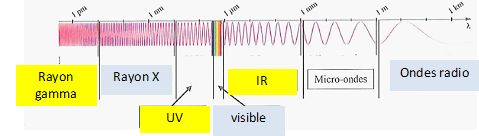
Compléter le schéma
en précisant les noms des différents domaines de longueurs d'onde.
( Visible, UV, ondes radio, rayons X, IR, rayons gamma ).
A quel
préfixe multiplicateur correspond le préfixe :
nano : 10-9 ; micro : 10-6 ; giga : 109.
Convertir
:
0,2 L= 200 mL ; 0,06 mg = 6 10-5 g = 6 10-5 109
ng = 6 104 ng.
0,100 g/L =0,1 * 109 ng/ 106 µL =100 ng/ µL ;
10 Hertz en seconde. Impossible une fréquence en hertz est l'inverse
d'un temps en seconde ( 10 Hz = 10 s-1 ).
0,3 g = 0,3 103 mg= 300 mg ; 10 mL = 10 cm3.
|
Chimie.
Chaque atome est représenté par le symbole AZX. Que représente ces
trois lettres ?
A : nombre de nucléons ; Z : numéro atomique, nombre de protons ; X :
symbole de l'élément chimique.
Compléter
le tableau :
Nom
|
sodium
|
bore
|
carbone
|
manganèse
|
mercure
|
étain
|
azote
|
or
|
Symbole
|
Na
|
B
|
C
|
Mn
|
Hg
|
Sn
|
N
|
Au
|
Compléter le tableau
:
Nom
|
chlorure
|
ion
potassium
|
ion permanganate
|
ion
ammonium
|
Symbole
ou formule
|
Cl-
|
K+
|
MnO4-
|
NH4+
|
Compléter le tableau
:
Nom
|
éthanol
|
éther
diéthylique
|
sulfate de magnésium
|
acétate
d'éthyle
|
trichlorure d'aluminium
|
Formule
brute
|
C2H5OH
|
C2H5OC2H5 |
MgSO4
|
CH3COOC2H5
|
AlCl3
|
acide
sulfurique
|
dichlorométhane
|
hydroxyde de sodium ( soude )
|
cyanure de potassium
|
cyclohexane
|
|
H2SO4
|
CH2Cl2
|
NaOH
|
KCN
|
C6H12
|
|
Donner l'état
physique des composés ci-dessous à température ambiante et pression
atmosphérique.
Hydroxyde de sodium : solide ; diiode : solide ; diazote : gaz ;
mercure : liquide ; acétate de sodium : solide ; dibrome : liquide.
Equilibrer les
réactions chimiques suivantes :
Al + 3HCl ---> AlCl3 + 1,5H2.
C3H8 + 5O2
---> 3CO2 + 4H2O.
Cr2O72- + 14H+ +6 e-
---> 2Cr3+ +7 H2O.
Classer par ordre de
pH croissant les solutions suivantes :
HCl à 1 mol/L ; CH3CO2H à 0,01 mol/L
; NaCl à 0,1 mol/L ; NH3 à 0,01 mol/L ; NaOH à 0,01 mol/L ;
NaOH à 1 mol/L.
Calculer
le pH de la solution NaOH à 0,01 mol/L et de HCl à 0,01 mol/L.
HCl, acide fort : pH = -log C = - log 0,01 = 2 ; NaOH, basse forte : pH
= 14 + log C = 14 + log 0,01 = 12.
Qu'est-il
plus dangereux de faire ?
Mettre l'acide dans l'eau ( non) ; mettre l'eau dans l'acide ( oui )
risque de projection de gouttes d'acide.
Sur l'étiquette d'un flacon contenant de l'acide nitrique, on lit : densité 1,41 ; HNO3 70 % ; masse molaire 63 g/mol.
Quelle est la concentration de cet acide ?
1 L de cet acide a une masse égale à 1,41 kg = 1410 g et contient 1410*0,70 = 987 g d'acide pur.
Quantité de matière d'acide nitrique : 987 / 63 = 15,7 moles dans 1 L.
On veut préparer 1 L d'une solution d'acide nitrique à 0,10 mol/L. Quel volume d'acide commercial faut-il prélever ? préciser le matériel à utiliser.
Facteur de dilution F = 15,7 / 0,1 = 157.
Volume de la fiole jaugée : 1,00 L ; volume à prélever : 1000 / 157 = 6,4 mL. Utiliser une pipette ou une burette graduée.
Prélever 6,4 mL d'acide commercial à l'aide d'une pipette graduée ;
verser cette prise dans la fiole jaugée contenant environ 0,5 L d'eau
distillée ; compléter jusqu'au trait de jauge avec de l'eau distillée ;
boucher et agiter pour rendre homogène.
|
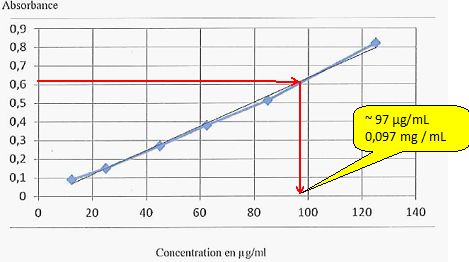
Spectrophotométrie UV.
On dose par spectrophotométrie UV une protéïne à l
= 562 nm. On a préparé plusieurs solutions à différentes concentrations
pour tracer une courbe d'étalonnage. Nous avons une solution inconnue
qui absorbe à 0,63.
Quelle est sa concentration en mg/ mL ?
Concentration en µg / mL
|
125
|
85
|
62,5
|
45
|
25
|
12,5
|
Absorbance
|
0,82
|
0,513
|
0,38
|
0,27
|
0,15
|
0,09
|
Donner la famille à laquelle appartiennent les molécules suivantes.
Molécule
|
CH3-(CH2)3-COOH
|
CH3-(CH2)3-OH |
CH3-CH NH2-CH3
|
CH3-COO-C2H5
|
CH3-CHO
|
CH3-MgBr
|
Fonction
|
acide carboxylique
|
alcool primaire
|
amine primaire
|
ester
|
aldehyde
|
magnésien
|
Compléter le montage suivant :
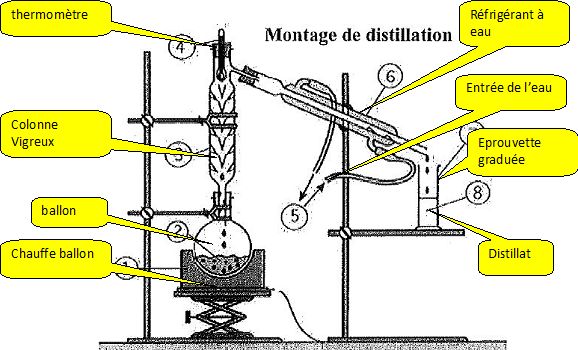
Quel est le rôle de l'élévateur ?
Il permet de monter ou descendre le chauffe ballon, c'est à dire de
supprimer le chauffage : le ballon peut alors se refroidir à l'air.
On ne connaît pas le volume d'un ballon, le technicien mesure le périmètre qui vaut 40 cm. Quel est son volume en mL ?
le ballon est assimilé à une sphère de rayon R = 40 / 2p = 40 / 6,28 =6,37 cm.
Volume d'une sphère : 4 /3 p R3 = 4/3*3,14*6,373 ~1,08 103 mL.
Un litre d'acétone coûte 6 € et il augmente de 10 % chaque année, quel sera son prix dans 2 ans ?
Prix dans 1 an : 6*1,1 = 6,6 € ; prix dans deux ans : 6,6*1,1 =7,26 €.
|
|


