|
|
|
|
Thermochimie.
L'eau oxygénée se décompose spontanément selon la réaction :
H2O2(l) ---> ½O2(g) + H2O(l).
Exprimer la constante d'équilibre K de cette réaction.
K = PO2½ / [H2O2].
On
dilue de l'acide acétique dans l'eau de façon à obtenir une solution à
0,1 mol/L en acide acétique.
Donner l'expression littérale de l'enthalpie standard de cette réaction à 298 K, puis la calculer.
DrH° =DfH°(H2O(l)) +½DfH°(O2)- DfH°(H2O2(l)).
DrH° =-285,8-(-187,8) = -98 kJ/mol.
DrH° étant négative, la décomposition de l'eau oxygénée est exothermique.
Donner l'expression littérale de la variation d'entropie standard de cette réaction à 298 K puis la calculer.
DrS° =S°(H2O(l)) +½S°(O2)- S°(H2O2(l)).
DrS° =70 +0,5*204,8-143 = 29,4 J mol-1 K-1.
DrS° est positive : l'état final, constitué d'un gaz et d'un liquide, est plus désordonné que l'état initial ( état liquide ).
On considère que l'enthalpie standard de réaction et l'entropie standard de réaction sont indépendantes de la température.
Exprimer l'enthalpie libre standard de réaction en fonction de T et la calculer à 298 K.
DrG° =DrH° - T DrS° = -98 103 -298*29,4 = -1,067 105 ~1,07 105 J mol-1.
Ce résultat confirme-t-il que la décomposition de l'eau oxygénée est spontanée ? Justifier.
DrG° étant négative, la décomposition de l'eau oxygénée est spontanée.
Calculer K à 298. Que peut-on en déduire ?
DrG° = - RT ln K ; lnK = 1,067 105 /(8,314*298) =43 ; K = 5,1 1018.
K étant grande, la réaction est totale.
Pourquoi est-il cependant possible de trouver au laboratoire des solutions aqueuse d'eau oxygénée ?
La réaction de décomposition de l'eau oxygénée est très lente à 298 K.
|
.
|
Dosage d'une solution d'eau oxygénée.
Pour contrôler le titre d'une eau oxygénée, on dose par une solution de permanganate de potassium à CKMnO4 = 0,02 mol/L, une prise d'essai VP = 10,0 mL de solution d'eau oxygénée acidifiée. L'équivalence est obtenue pour une coulée VE =19,50 mL de permanganate de potassium.
Ecrire l'équation de la réaction du dosage.
2 fois { MnO4-
+ 8H+ + 5e- = Mn2+ + 4H2O
} réduction
5 fois {H2O2 =
O2 + 2H+ + 2e- }
oxydation
2 MnO4- + 5 H2O2 + 6H+
donne 5 O2 + 2 Mn2+ + 8H2O. (1).
Pourquoi est-il nécessaire d'acidifier la preise d'essai ?
L'ion permanganate n'est oxydant qu'en milieu acide
Donner l'expression de la constante K associée à cette réaction.
K = [Mn2+]2PO25 / ([MnO4-]2[H2O2]5[H+
]6.
Calculer K à partir des potentiels standards redox des couples mis en jeu et conclure.
E1 =E°(MnO4-
/Mn2+) + 0,06 /10 log ( [MnO4-]2[H+
]8 / [Mn2+]2)
E2 = E°( H2O2 / O2) +0,06/10 log (( PO25[H+
]2/[H2O2]5 )
A l'équilibre E1 =E2 ;
E°(MnO4-
/Mn2+) + 0,06 /10 log ( [MnO4-]2[H+
]8 / [Mn2+]2) =E°( H2O2 / O2) + 0,06/10 log ( PO25[H+
]2/[H2O2]5 ).
E°(MnO4-
/Mn2+) -E°( H2O2 / O2) = 0,06/10 log K ; log K = (E°(MnO4-
/Mn2+) -E°( H2O2 / O2))*10/0,06.
log K = (1,51-0,68)*10/0,06 =138. K
K est très grande, la réaction est totale. = 2,1 10138.
Qu'appelle-t-on équivalence ?
A
l'équivalence d'un dosage les quantités de matière des réactifs sont en
proportions stoechiométriques. Avant l'équivalence, l'un des réactifs
est en excès, après l'aquivalence, l'autre réactif est en excès.
Comment repère-t-on l'équivalence de ce dosage
?
L'ion
permanganate joue un double rôle, celui de réactif et celui
d'indicateur de fin de réaction. L'ion permanganate est la seule espèce
colorée ( violet).
Etablir la relation à l'équivalence. Calculer la concentration de l'eau oxygénée.
n(MnO4-) = CKMnO4 VE ; n(H2O2) =[H2O2] VP.
D'après les nombres stoechiométriques de l'équation (1) : 2,5 n(MnO4-) =n(H2O2)
2,5 CKMnO4 VE = [H2O2] VP.
[H2O2] = 2,5 CKMnO4 VE / VP =2,5 *0,02 *19,5 / 10,0 = 0,0975 ~0,098 mol/L.
|
|
On désire suivre ce dosage par potentiométrie à intensité nulle.
Quelles électrodes utilise-t-on ?
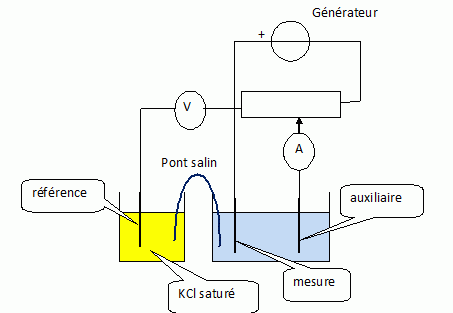
L'électrode de travail ( mesure ) doit être maintenue à un potentiel
constant : aucun courant électrique ne doit traverser l'électrode
de référence (sinon son potentiel serait modifié). Une troisième
électrode est donc nécessaire. Le courant circule alors entre
l'électrode de mesure et l'électrode auxiliaire ; le potentiel
est imposé entre l'électrode de mesure et l'électrode de référence.
On sépare physiquement l'électrode de référence de la solution à étudier. L'électrode de mesure est une électrode de platine inerte
vis à vis des différents réactifs ( inattaquable).
|
|
