|
|
|
|
Quelle est la
signification des pictogrammes suivants ?

1 : cancérigène ; 2 : danger pour l'environnement ; 3 : substance
comburante ; 4 : gaz sous pression.
Qu'est
ce qu'un produit CMR ?
Produits chimiques
cancérogènes et/ou mutagènes et/ou toxiques pour la reproduction.
Citer
trois équipements de protection individuelle.
Lunettes, gants, blouses, chaussures de sécurité.
Citer deux
équipements de protection collective.
Extincteur, Postes de sécurité
microbiologiques.
Sorbonnes pour la protection contre le risque
chimique, pour les produits volatils toxiques par inhalation
Ventilation correcte des locaux.
Conteneurs adaptés pour les
produits souillés.
Stockage réglementaire des
produits dangereux.
Signalisations des zones où
sont manipulés des agents biologiques ou des radioéléments.
Indiquer par une croix dans le tableau
l'endroit où vous jeter les solutions suivantes.
Produit
|
Acides
minéraux
|
Acides
organiques
|
Solvants
halogénés
|
Solvants
non halogénés
|
Bases
sels minéraux
|
Evier
|
sulfate
de cuivre
|
|
|
|
|
X
|
|
acétone
|
|
|
|
X
|
|
|
HCl
|
X
|
|
|
|
|
|
CCl4
|
|
|
X
|
|
|
|
ammoniaque
|
|
|
|
|
X
|
|
hydroxyde
de sodium
|
|
|
|
|
X
|
|
acétonitrile
|
|
|
|
X
|
|
|
CH3OH
|
|
|
|
X
|
|
|
HCOOH
|
|
X
|
|
|
|
|
KCl
10-3 M
|
|
|
|
|
|
X
|
Peut-on stocker
ensemble les produits suivants ?
Propanol et dichromate de potassium : non ( réaction réducteur oxydant ).
Acétone et éther diéthylique : oui.
Nitrate d'argent et chlorure de nickel : non ( réaction de
précipitation ).
Hypochlorite de sodium et acide acétique : oui.
Cyanure de potassium et acide sulfurique : non ( dégagement HCN toxique
).
Résoudre
en détaillant : 3 x2 +4 x +1 = 0.
D = 42-4*3*1
=4 ; D½ =
±2.
x1 = (-4 +2 ) / (2*3) =-1/3 ; x2 = (-4 -2 ) /
(2*3) = -1.
Comment appelle-t-on
les domaines de longueur d'onde suivants :
10 nm - 400 nm : UV ; 400 nm - 800 nm : visible ; 800 nm - 14 µm : IR.
|
Cconvertissez les
mesures suivantes dans l'unité demandée.
1,54 Angström = 1,54 10-10
m ; 1,2 nm = 12 Angström ; 40 MBq = 40 106 Bq ; 38 µL = 38 10-6
L ; 12 000 cm3 = 12 L.
On considère la loi suivante : A = e C l.
Quel est
le nom de cette loi ? Loi de Beer- Lambert.
Donner le
nom de chaque terme.
A
: absorbance ; e :
coefficient d'extinction molaire ; C : concentyration molaire ; l :
largeur de la cuve.
Définissez
A en fonction de l'intensité incidente I0.
A = - log (I/I0) = log ( I0/I).
Cette loi
peut-elle s'appliquer aux techniques spectroscopiques suivantes ?
RMN : non ; UV- visible : oui ; IR : oui ; CPG : non.
Donner le
nombre de protons, de neutrons et d'électrons des atomes ou des ions
suivants.
atome
ou ion
|
Nb
de proton
|
Nb
de neutron
|
Nb
d'électron
|
9341Nb
|
41
|
93-41
=52
|
41
|
5224Cr
|
24
|
52-24=28
|
24
|
9341Nb3+
|
41
|
93-41=52
|
41-3 =
38
|
6931Ga
|
31
|
69-31=38
|
31
|
| 7131Ga |
31
|
71-31
=40
|
31
|
Donner le schéma de
Lewis des ions ou molécules suivantes.
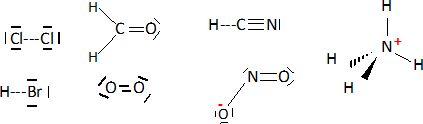
Equilibrer
les réactions suivantes :
Fe2O3 + 3 CO ---> 2 Fe + 3 CO2.
NH4NO2 ---> N2 + 2 H2O.
C2H5SH + 4,5 O2
---> 2 CO2
+ 3 H2O
+ SO2.
Cr2O72- + 14 H+ + 6 Fe2+
---> 2 Cr3+
+ 6 Fe3+
+ 7 H2O.
2 BiCl3
+ 3 H2S
---> Bi2S3 + 6 HCl.
|
On dispose d'une solution aqueuse initiale d'un composé A de concentration C1 = 0,25 mol/L.
Quel volume de cette solution faut-il prélever pour préparer 750 mL d'une solution aqueuse de A de concentration C2 = 0,05 mol/L ?
Facteur de dilution F = C1/C2 = 0,25/0,05 = 5.
Volume de solution mère à prélever : 750 / 5 = 150 mL.
On mélange 150 mL de la solution initiale ( C1 = 0,25 mol/L) et 225 mL d'une solution aqueuse de A de concentration C3 = 0,15 mol/L.
Quelle est la nouvelle concentration du mélange ?
Quantité de matière de A : 0,15 *0,25 + 0,225*0,15 = 0,07125 mol.
Concentration = quantité de matière / volume total = 0,07125 / (0,15+0,225) =0,19 mol/L.
On fait réagir de la limaille d'aluminium avec du soufre en poudre. La réaction est totale. M(Al) = 27 g/mol ; M(S) = 32 g/mol.
Ecrire l'équation chimique qui a lieu. On obtient Al2S3.
2 Al + 3 S ---> Al2S3.
On fait réagir 5,00 g d'aluminium et 7,00 g de soufre.
Déterminer le réactif limitant, la masse de Al2S3 ainsi que la masse de réactif en excès.
nAl = 5,00 / 27 = 0,1852 mol ; nS = 7,00 / 32 = 0,21875 mol.
Etat
|
avancement (mol)
|
2 Al
|
+ 3S
|
---> Al2S3 |
initial
|
0
|
0,1852
|
0,21875
|
0
|
en cours
|
x
|
0,1852-2x
|
0,21875-3x
|
x
|
fin
|
xmax=0,07292 |
0,1852-2xmax
0,1852-2*0,07292 =0,03937
|
0,21875-3xmax =0
|
xmax=0,07292 |
Si Al est en défaut : 0,1852-2xmax =0 ; xmax =0,0926 mol.
Si S est en défaut : 0,21875-3xmax=0 ; xmax =0,07292 mol.
On retient la plus petite valeur : le soufre est le réactif limitant.
masse Al restant : 0,03937*27 = 1,06 g.
Masse Al2S3 : 0,07292*(27*2+3*32) =10,9 g.
Identifier les réactions suivantes :
Ag3AsO4 ---> 3 Ag+ + AsO4-. Dissolution d'un solide.
Pb2+ + 2Cl- ---> PbCl2. Précipitation.
6 HNO3 + 2 NH3 ---> 6NO2 + 6H2O + N2. Oxydoréduction.
MnO4- + 5 Ag + 8H+ ---> 5Ag+ + Mn2+ + 4H2O. Oxydoréduction.
CH3COOH + NH3 ---> NH4+ + CH3COO-. Acide base.
CH3COOH + C2H5OH ---> CH3COO-C2H5 + H2O. Estérification.
Calculer la concentration molaire du produit suivant :

Masse d'acide dans 1 L : 1,41 *0,676 = 0,95316 kg = 953,16 g.
Quantité de matière d'acide : 953,16 / 63,01 = 15,1 mol dans 1 L.
Vous devez préparer 500 mL d'une solution 10-2 M de sulfate de nickel (II) hexahydraté.
Quelle masse de produit pesez-vous ?
Quantité de matière : n =5 10-3 mol.
Masse molaire NiSO4, 6H2O : M = 58,69 +32+4*16 +6*18 =262,69 g/mol.
Masse à peser : m = n M = 5 10-3 *262,69 ~1,3 g.
|
Acide-base.
Quelles sont les valeurs de [H3O+] et [HO-] dans l'eau pure ?
A 25°C, [H3O+] = [HO-] = 10-7 mol/L.
Que vaut [HO-] dans une solution aqueuse où [H3O+] =3,2 10-3 mol/ L ? Cette solution est-elle acide, neutre ou basique ?
[HO-] =10-14 / [H3O+] =10-14 /(3,2 10-3)=3,1 10-12 mol/L.
pH = - log(3,2 10-3) =2,5, valeur inférieure à 7, la solution est donc acide.
Que vaut [H3O+] dans une solution aqueuse où [HO-] = 6,9 10-12 mol/L ? cette solution est-elle acide, neutre ou basique ?
[H3O+] =10-14 /(6,9 10-12)=1,5 10-3 mol/L.
pH = - log(1,5 10-3)=2,8. La solution est acide.
L'acide lactique, noté AH, est un acide faible qui a pour base conjuguée A-. pKa(AH / A-) = 3,9.
Ecrire l'équation de déprotonation de l'acide lactique dans l'eau.
AH + H2O = A- + H3O+.
Un lait frais a un pH = 6,4. Quelle est la forme majoritaire présente ?
A pH < pKa la forme A est majoritaire.
L'acide ascorbique est une molécule chirale.
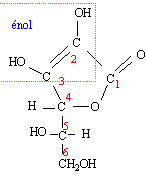
Donnez la définition d'une molécule chirale.
Une molécule chirale n'est pas superposable à son image dans un miroir.
Quelle est la formule brute de l'acide ascorbique ?
C6H8O6.
Quel est le nom du groupe fonctionnel porté par le carbone n° 6 ?
Alcool primaire.
Combien la molécule contient-elle de carbones tétragonaux, trigonaux, digonaux ?
Les atomes de carbone n°4, 5 et 6 sont tétragonaux. Les atomes de carbone n° 1, 2 et 3 sont trigonaux.
|
Quelle est la structure spatiale des carbones n°1, 2 , 5 et de l'oxygène porté par le carbone n° 5 ?
Les atomes de carbones n°1 et 2 sont trigonaux : structure triangulaire
plane. L'atome de carbone n°5 est tétragonal : structure tétraèdrique.
L'atome d'oxygène porté par le carbone n°5 : structure en forme d'un V.
Quels sont les atomes de carbone asymétriques ?
Atomes de carbone n° 4 et 5, tétragonaux et liés à 4 atomes ou groupes d'atomes différents..
|



