|
|
|
Déterminer la configuration électronique
des espèces suivantes :
C( Z = 6) : 1s2 2s2 2p2 ; Ar ( Z =18 )
1s2 2s2
2p6 3s2
3p6 ;
Ti ( Z =22 ) 1s2 2s2
2p6 3s2
3p6 4s2 3d2
;
Ca2+( Z = 20) 1s2 2s2
2p6 3s2
3p6 ; S2- ( Z
=16 ) 1s2
2s2 2p6 3s2
3p6 ;
Br-(Z=35) : 1s2
2s2 2p6 3s2
3p6 3d10
4s2 4p6
.
Quelles sont les espèces isoélectroniques ?
Ar, Ca2+, S2- : 1s2
2s2 2p6 3s2
3p6 .
Citer un élément chimique
appartenant à chacune des familles suivantes.
Alcalins : sodium, potassium ; Alcalino-terreux : calcium, magnésium ;
Halogènes : chmore, fluor. Gaz rares : argon, hélium.
Tout atome est caractérisé par son nucléide AZX.
Définir les lettres X, A
et Z.
X : symbole de l'élément chimique ;
A : nombre de nucléons ( nombre de masse )
Z : nombre de charge, numéro atomique.
Quelle est la molécule la
plus simple que vous pouvez composer avec :
Le carbone et l'hydrogène : CH4, méthane.
L'oxygène et l'hydrogène : H2O, eau.
L'azote et l'hydrogène : NH3, ammoniac.
On effectue la combustion du propane C3H8 avec le
dioxygène, on obtient du dioxyde de
carbone et de l’eau. Ecrire la
réaction et l’équilibrer.
C3H8
+ 5 O2 ---> 3 CO2 + 4H2O.
Soit la réaction de désintégration radioactive de l’isotope 238 de
l’Uranium :
23892U ---> 23490Th
+ 42He
+ g.
Définissez le terme «
isotope ».
Deux isotopes ne diffèrent que par leur nombre de neutrons. Ils ont le
même numéro atomique Z.
Quel est le type de
radioactivité mis en oeuvre ? Comment arrêter ce rayonnement ?
Type alpha; les rayons alpha sont arrêtés par une simple feuille de
papier.
Par contre les rayons g
nécessite plusieurs cm de plomb.
Quelle est la loi de
décroissance radioactive ? Définissez la période radioactive.
A = A0 exp (-l t).
La période radioactive est la durée au bout de laquelle l'activité
initiale est divisée par deux.
|
.
Réactions
en solution aqueuses.
Conductimétrie.
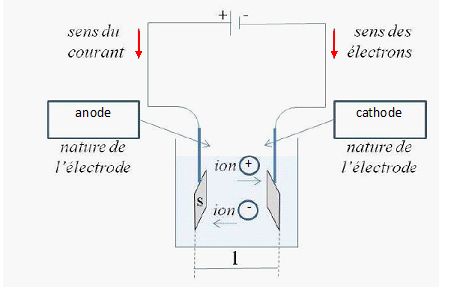
Considérons un conductimètre dont la cellule de mesure est constituée
de deux plaques parallèles, de même surface S et distantes d’une
longueur l.
Indiquer sur le schéma suivant
le sens du courant, le sens des électrons, la nature des électrodes
(anode ou cathode) ainsi que le signe des ions selon leur sens de
déplacement dans
la solution.
Soit G la conductance, σ la
conductivité de la solution et K la constante de la cellule.
Donner la formule de K ainsi que celle de la conductance. Préciser les
unités de G, σ et K.
G = K s ; K = S / l avec S
en m2 et l en mètre, K en mètre.
G : conductance en siemens ( S) ; s : conductivité en S m-1.
Une
solution de nitrate de sodium (Na+ + NO3-),
de concentration c, a pour conductivité 273 μS.cm-1 à 25°C.
A 20°C, la conductivité de cette solution sera-t-elle supérieure ou
inférieure ?
La conductivité augmente avec la température car la viscosité du
solvant diminue. A 20 °C la conductivité sera inférieure de celle
mesurée à 25°C.
A 25°C, les conductivités ioniques des ions sont : λ(NO3-)
= 71,4 S.cm2.mol-1; λ(Na+) = 50,1 S.cm2.mol-1.
Calculer la concentration c de
la solution en mol.L-1 puis en mg.L-1.
s = λ(NO3-)
[NO3-] +λ(Na+) [Na+] = (λ(NO3-)+λ(Na+))
c ;
s = 273 10-6
/ 10-2 = 273 10-4 S m-1 ; λ(NO3-)
= 71,4 10-4 S m2 mol-1 ; λ(Na+)
= 50,1 10-4 S m2 mol-1 .
c = 273 / (71,4 +50,1) = 2,25 mol m-3 = 2,25 10-3
mol / L.
M(NaNO3) = 23+14+3*16 =85 g/mol ; 2,25 10-3 * 85
= 0,191 g/L = 191 mg/L.
pH-métrie – Titrage d’un vinaigre
Le but est d’effectuer le titrage d’un vinaigre. Pour cela, l’acide
éthanoïque du vinaigre est titré par une solution d’hydroxyde de sodium
de concentration c = 0,10 mol.L-1. Avant de
réaliser ce titrage, une dilution au dixième du vinaigre est effectuée. La solution diluée obtenue sera appelée S1.
Donner le nom usuel de l’acide éthanoïque.
Acide acétique.
Lorsqu’une solution de soude est préparée à partir de pastilles de soude, le titre de la solution est-il connu précisément ? Justifier.
Non, car les pastilles de soude sont hygroscopiques, elles fixent de l'eau.
Titrage de l’acide éthanoïque du vinaigre
Le volume de solution S1 à titrer est V1 = 20 mL.
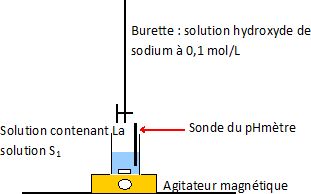
Faire un schéma annoté du
montage permettant de suivre l’évolution du pH en fonction du volume v
de solution d’hydroxyde de sodium versé.
Ecrire le couple
acide/base correspondant à l’acide éthanoïque. Donner également
l’équation de la réaction chimique de ce titrage.
CH3-COOH / CH3-COO-.
CH3-COOH + HO- ---> CH3-COO- + H2O.
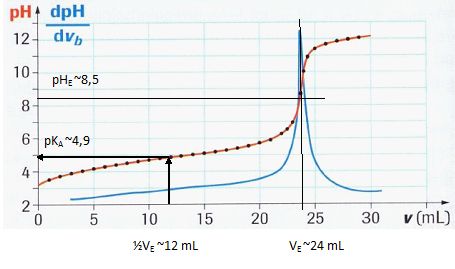
Les mesures réalisées, traitées par informatique, ont permis de tracer les courbes représentées sur la figure ci-après. Graphiquement, déterminer le point d’équivalence E et ses
coordonnées (vE et pHE) ainsi que le pKa de l’acide éthanoïque (préciser la formule du Ka).
Ka = [CH3COO-][H3O+] / [CH3COOH].
Calculer la concentration c1 de la solution S1.
A l'équivalence c VE = c1 V1 ; c1 = c VE /V1 = 0,10 *24 / 20 = 0,12 mol/L.
Quel est l’intérêt de la dilution au dixième ?
On utilise une solution de soude moins concentrée, donc moins dangereuse ( moinx corrosive).
Indiquer comment vous
réaliseriez cette dilution au dixième (calcul des volumes prélevés,
choix de la verrerie utilisée, protocole incluant deux méthodes pour
déterminer le point d’équivalence).
Fiole jaugée de 100 mL; pipette jaugée de 10 mL, pisette d'eau distilée.
La méthode des tangente, ou le pic de la fonction dpH/dvb permettent de déterminer le point équivalent E.
|
Calculer la concentration c0 en acide éthanoïque du vinaigre initial. Préciser sa normalité.
c0 = 10 c1 = 1,2 mol/L; N = 1,2 mol/L.
Le degré d’acidité du vinaigre est la masse, en grammes, d’acide éthanoïque pur dans 100 g de vinaigre. Calculer le degré d’acidité du vinaigre étudié.
Masse d'acide éthanoïque pur dans 1 L de vinaigre : 1,2 *M(acide éthanoïque) = 1,2 *60 = 72 g.
En supposant que la masse volumique du vinaigre est proche de 1, masse de 1 L de vinaigre : 1000 g.
Soit 7,2 g d'acide éthanoïque dans 100 g de vinaigre : degré = 7,2.
La titre indiqué sur la bouteille de vinaigre est de 7°. Comparer vos résultats avec cette valeur.
Ecat relatif : (7,2-7) / 7 ~0,03 ( 3%). Le résutat du titrage est en accord avec la valeur lue.
|


