L'acide lactique
: Bts analyses biologiques médicales 2013
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
|
|
|
|
|
Afin de connaître l’état de forme physique des athlètes de haut niveau,
une analyse médicale est réalisée très régulièrement et comporte
notamment un dosage de l’acide lactique dans le sang. Une enzyme
appelée lactase-déshydrogénase réduit l’acide pyruvique CH3-CO-COOH dans le muscle durant les exercices physiques en acide (S)- lactique CH3-CHOH-COOH, principal responsable des crampes ; le processus est inversé lorsque le muscle est au repos.
Considérations structurales.
Écrire la formule développée de l’acide lactique et celle de l’acide pyruvique. Donner leurs noms en nomenclature systématique. Entourer les groupes fonctionnels dans ces formules et indiquer leurs noms.
Donner
la définition d’un carbone asymétrique et indiquer par un astérisque,
sur les formules développées précédentes, la présence du ou des
carbone(s) asymétrique(s) dans les molécules d’acide lactique et d’acide pyruvique.
Acide lactique ou acide 2-hydroxypropanoïque ; acide pyruvique ou acide 2-oxopropanoïque.
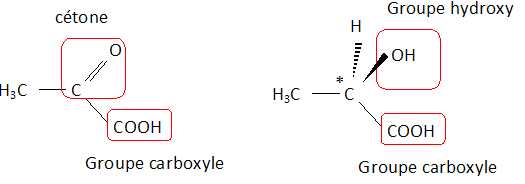
Un atome de carbone asymétrique est un carbone tétragonal lié à 4 atomes ou groupe d'atomes différents.
Représenter
suivant la convention de CRAM, l’acide (S)-lactique. Justifier cette
représentation en donnant l’ordre de priorité des substituants.
Numéroter de façon décroissante
chacun des quatre substituants selon son numéro
atomique. OH (1) ; COOH (2) ; CH 3 (3) ; H (4). On place alors l'atome (ou le groupement) de
numéro le plus élevé
derrière. On regarde dans quel sens, sens horaire ou
trigonométrique, on passe du numéro 1, au 2,
au 3. - Si le sens de rotation est le sens horaire (ou
anti-trigonométrique), le carbone est Rectus (R), - Si le sens de rotation est le sens
trigonométrique (ou anti-horaire), le carbone est
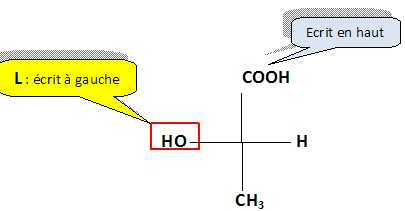
Sinister (S). 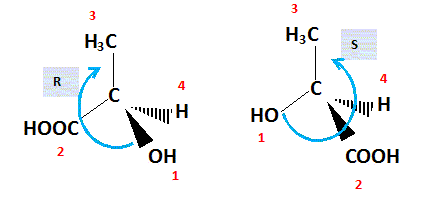 Faire la représentation de Fischer de l’acide (L)-lactique. Faire la représentation de Fischer de l’acide (L)-lactique.
Enthalpie de formation de l’acide lactique.
La combustion complète de l’acide lactique à l’état liquide conduit à la formation d’eau et de
dioxyde de carbone selon la réaction d’équation : C3H6O3 (l) + 3 O2 (g) = 3 CO2 (g) + 3 H2O (l)
La variation d’enthalpie de cette réaction vaut DH°comb = -1364 kJ.mol-1 (à 298 K)
Exprimer DH°comb en fonction des enthalpies molaires standard de formation des espèces mises en jeu dans cette réaction.
DH°comb =3DH°f (CO2 (g))+3DH°f ( H2O (l))-3 DH°f ( O2 (g)) - DH°f ( C3H6O3 (l)).En déduire, en kJ/mol, la valeur de l’enthalpie molaire standard de formation de l’acide lactique, à l’état liquide, à 298 K.
DH°f ( C3H6O3 (l)) = 3DH°f (CO2 (g))+3DH°f ( H2O (l))-3 DH°f ( O2 (g)) -DH°comb.
DH°f ( C3H6O3 (l)) =3*(-393) +3(-286) -3*0- (-1364)= -673 kJ mol-1.
|
| .
. |
|
|
Réactions mettant en jeu l’acide lactique.
L’acide lactique est mis en jeu dans des réactions acido-basiques.
Écrire l’équation de la réaction de l’acide lactique avec l’eau.
CH3CHOH-COOHaq + H2O = CH3CHOH-COO-aq +H3O+aq.
Une solution aqueuse d’acide lactique de concentration 8,0.10-3 mol. L-1 possède un pH égal à 3,0. L’acide lactique est-il un acide fort ou faible ? Justifier.
Dans l'hypothèse d'un acide fort pH = -log c = - log(8,0.10-3) =2,1. Or la mesure indique 3. L'acide lactique est un acide faible.
L’acide lactique est mis en jeu dans des réactions d’oxydoréduction.
Écrire
la demi-équation du couple d’oxydoréduction qui intervient lors de la
transformation de l’acide pyruvique en acide (S)-lactique.
CH3CO-COOH aq +2e- +2H+ =CH3CHOH-COOH aq.
|
.
|
|
L’acide lactique est aussi le composé majoritaire obtenu par hydratation du composé de formule : CH2=CH-COOH.
Cette réaction est-elle une addition ou une substitution ?
Addition d'eau sur la double liaison éthylénique.
Justifier pourquoi l’acide lactique est le composé obtenu de façon majoritaire.
OH se fixe sur le carbone de la double liaison le plus substitué (règle de
Markownikov).
L’acide
lactique est utilisé comme monomère pour la production du PLA (acide
polylactique) qui est un polyester synthétique biodégradable. Ce
polymère a de nombreuses applications médicales. Il est employé en
particulier comme fil de suture résorbable, comme fibre pour la
fabrication des couches biodégradables…
Une réaction d’estérification est possible entre les deux groupes fonctionnels présents dans l’acide lactique.
Écrire l’équation de la réaction susceptible de se produire entre deux molécules d’acide lactique.
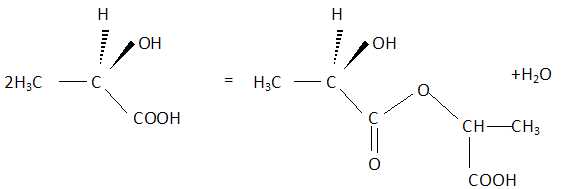
Indiquer deux caractéristiques de cette réaction.
Cette réaction est lente et limitée par l'hydrolyse de l'ester.
Expliquer pourquoi la réaction peut se poursuivre et donner une molécule de grande masse molaire.
L'ester formé possède encore une fonction acide carboxylique et une fonction alcool : la polymérisation peut donc se poursuivre.
Détermination de la lactatémie.
La
détermination de la lactatémie, c'est-à-dire du taux d’acide lactique
dans le sang, peut se faire en utilisant une technique enzymatique. Il
s’agit d’utiliser la déshydrogénase de
l’acide lactique (LDH) qui catalyse, au pH de l’organisme, l’équilibre :
pyruvate + NADH + H+ = lactate + NAD+.
Les molécules NADH et NAD+ sont des coenzymes d’oxydoréduction présents dans les cellules vivantes.
Au
pH physiologique, l’équilibre précédent est déplacé dans le sens de la
formation du lactate. En augmentant le pH du milieu et en ajoutant une
grande quantité de semicarbazide qui réagit avec le pyruvate, on peut
déplacer l’équilibre dans le sens indirect et former quantitativement
la NADH à partir du lactate.
La mesure de l’absorbance du milieu permet de déterminer la concentration en NADH et d’accéder à la concentration en lactate.
|
|
Expliquer pourquoi l’augmentation du pH déplace l’équilibre précédent dans le sens indirect.
pyruvate + NADH + H+ = lactate + NAD+.
Si le pH croît, la concentration en ion H+aq diminue. L'équilibre est déplacé dans le sens indirect, formation d'ion oxonium. ( loi de modération ).
Le semicarbazide est un composé du type Z-NH2. La réaction qui s’opère entre ce dernier et le pyruvate est équivalente à celle d’un dérivé Z-NH2 et d’une cétone R-CO-R’.
Écrire l’équation de la réaction correspondante.
R-CO-R' + Z-NH2 = R - C=NZ-R' +H2O.
Expliquer le sens d’évolution de l’équilibre, pyruvate + NADH + H+ = lactate + NAD+, par ajout de semicarbazide.
La fonction cétone de l'ion pyruvate réagit avec le semicarbazide Z-NH2. L'équilibre est déplacé dans le sens indirect, formation d'ion pyruvate. ( loi de modération ).
La figure ci-dessous représente les spectres des espèces NAD+ et NADH.
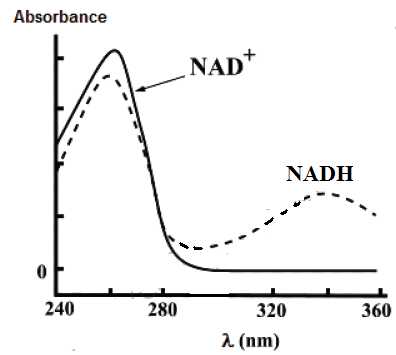
Si
l’on suppose que, dans cette gamme de longueurs d’onde, seules les deux
espèces précédentes peuvent avoir une incidence sur la valeur de
l’absorbance du milieu. Quelle
longueur d’onde de travail faudrait-il choisir pour déterminer
facilement la concentration en NADH à partir de la mesure d’absorbance?
Justifier la réponse.
La longueur d'onde de travail correspond à un maximum d'absorption pour
l'espèce étudiée. De plus seule cette espèce doit absorber à cette
longueur d'onde. On choisira 340 nm.
Il est possible de déterminer la concentration en NADH à partir de la loi de Beer- Lambert. Énoncer cette loi en explicitant chacun de ses termes.
La loi de
Berr-Lambert exprime la variation de
l'intensité lumineuse en fonction de la distance
parcourue dans un milieu transparent.
Lorsqu'une lumière monochromatique
d'intensité I0 traverse un milieu
homogène, l'intensité de la lumière
émergente I décroît exponentiellement
lorsque l'épaisseur l du milieu absorbant
augmente.
I = I0 . e (-
al)
a est une constante appelée coefficient
d'absorption, caractéristique du milieu et de la
longueur d'onde considérés.
Dans le cas des solutions, la loi de Beer fait intervenir
les concentrations.
I = I0 . e (-
elc)
où e
est un coefficient caractéristique de la
substance appelé coefficient d'absorbance
(L mol-1
cm-1),
l est
l'épaisseur de la cuve
(cm) et
c la concentration de la solution
(mol/L).
Cette loi est vérifiée lorsque la solution
est de concentration inférieure à : c < 0,1
mol.L-1.
La relation fondamentale utilisée en
spectrophotométrie est présentée sous
la forme :
A= log (I0/I) =
elc
( A est
l'absorbance
ou densité
optique)
Expliquer pourquoi la connaissance de cette concentration permet d’accéder à celle du lactate.
|
avanement volumique ( mol/L)
|
pyruvate
|
+NADH
|
+H+
|
=lactate
|
NAD+
|
initial
|
0
|
a
|
b
|
c
|
0
|
0
|
en cours
|
x
|
a-x
|
b-x
|
c-x
|
x
|
x
|
|
Connaissant la
concentration initiale et la concentration finale de NADH, on peut en
déduire la concentration "x" en ion lactate.
A(t) = constante fois (b-x) ; A(t=0) = constante fois b ; x = b(A(t=0) -A(t)) / A(t=0).
|
|