Origine
du plomb dans les eaux
: Bts Métiers de l'eau 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
|
|
|
|
|
Sulfure de plomb.
Donner la configuration électronique du soufre S à l’état fondamental. Z = 16.
1s2 2s2 2p6 3s2 3p4.
Donner la configuration électronique de l’ion sulfure S2–. Expliciter la démarche.
1s2 2s2 2p6 3s2 3p6.
L'atome
de soufre en gagnant deux électrons conduit à l'ion sulfure ; ce
dernier possède une couche électronique externe saturée ( règle de
l'octet )..
Écrire la réaction de dissolution du sulfure de plomb dans l’eau et exprimer le produit de solubilité associé Ks.
PbS(s) = Pb2+aq + S2-aq. Ks = [Pb2+aq][S2-aq].
On néglige le caractère basique de l’ion sulfure. pKs(PbS) = 26,6 ; M(Pb) = 207,2 g/mol.
Exprimer, puis évaluer la solubilité du sulfure de plomb PbS dans l’eau pure en mol.L–1, ainsi que la teneur tPb en plomb en mg.L–1.
La solution est électriquement neutre. [Pb2+aq]= [S2-aq] = s.
Ks = s2 ; s = Ks½ =(10-26,6)½ =5,012 10-14 ~5,01 10-14 mol/L.
tPb = 5,012 10-14 *207,2 =1,04 10-11 g/L = 1,04 10-5 µg/L.
Comparer
cette teneur en plomb, à la teneur limite (NF) ( 10 µg/L ) concernant
le plomb dissous, qui devra être appliquée à partir de décembre 2013.
La teneur en plomb tPb est très inférieure à cette norme.Carbonate de plomb.
Les ions Pb2+(aq), issus de la corrosion d’une paroi en plomb, peuvent réagir avec les anions CO32– et HO–, contenus
en concentrations importantes dans la couche limite en contact avec la
paroi. La solubilité du carbonate de plomb PbCO3 formé dépend du pH de l’eau qui circule dans la canalisation.
À
l’aide d’un diagramme de prédominance des espèces carbonatées en
fonction du pH, préciser l’espèce qui prédomine à pH = 11,5 puis celle
qui prédomine à pH = 7,5.
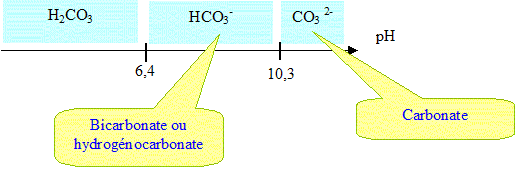 Écrire la réaction de dissolution du carbonate de plomb PbCO3(s) dans une eau de pH = 11,5. Écrire la réaction de dissolution du carbonate de plomb PbCO3(s) dans une eau de pH = 11,5.
PbCO3(s) = Pb2+aq + CO32-aq. Écrire la réaction de dissolution du carbonate de plomb PbCO3(s) dans une eau de pH = 7,5.
PbCO3(s) +H2O= Pb2+aq + HCO3--aq+ HO-aqOxydation des canalisations en plomb – exploitation du diagramme potentiel-pH du plomb.
Écrire la demi-équation redox pour le couple rédox Pb2+ (aq) / Pb(s).
Pb2+ (aq) +2e- = Pb(s).Écrire la relation de Nernst et calculer le potentiel du couple Pb2+ (aq) / Pb(s) pour une concentration C1 en ions plomb Pb2+(aq) de 10–4 mol.L–1.
E = E°(Pb2+ (aq) / Pb(s)) +0,03 log[Pb2+ (aq) ]= -0,13 +0,03 log(10-4) = -0,25 V.
Écrire l’équation de la réaction de précipitation de l’ion plomb Pb2+ (aq) en dihydroxyde de plomb Pb(OH)2(s). pKs (Pb(OH)2(s) = 14,4.
Pb2+ (aq) +2HO-aq = Pb(OH)2(s).Donner l’expression puis la valeur de la constante d’équilibre associée à cette réaction.
K = 1/([Pb2+ (aq)][HO-aq])2)= 1 /Ks.
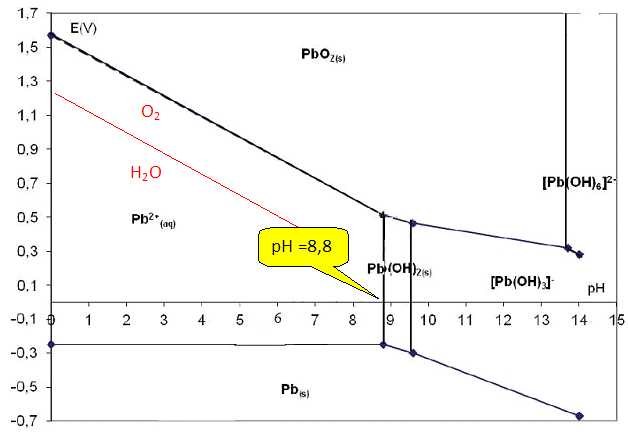
Calculer le pH de début de précipitation de Pb(OH)2(s) pour la concentration C1 en ions Pb2+(aq).
[HO-aq] = (Ks / [Pb2+ (aq)])½ =(10-14,4 / 10-4)½ =6,3 10-6 mol/L.
[H3O+aq] = 10-14 / [HO-aq] =10-14 / (6,3 10-6 )=1,6 10-9 mol/L ; pH = 8,8.À
l’aide du diagramme, donner la valeur lue du pH de début de
précipitation et vérifier que cette valeur est conforme à la valeur
calculée.
|
| .
. |
|
|
À l’aide des données, calculer les valeurs des potentiels du couple O2(g)/H2O(l) pour les pH de 0 et de 7.
E(O2(g)/H2O(l)) = 1,23 – 0,06 pH ; E(O2(g)/H2O(l)) = 1,23 V à pH=0
et E(O2(g)/H2O(l)) = 1,23-0,06*7 = 0,81 à pH=7.
Calculer aussi les valeurs des potentiels du couple H+ (aq)/H2(g) pour les pH de 0 et de 7.
E(H+(aq)/H2(g)) = – 0,06 pH ; E(H+(aq)/H2(g)) =0 à pH=0 et E(H+(aq)/H2(g)) =-0,42 à pH=7.
D’après les résultats précédents, que peut-on dire de la stabilité du plomb Pb(s) dans l’eau à pH = 7 ? Justifier la réponse.
A pH=7, O2 et Pb appartiennent à des domaines distincts. Le plomb peut être oxydé par le dioxygène dissous.
Lorsque de l’eau et de l’oxygène sont tous les deux présents, le plomb métallique est oxydé » en PbO.
|
.
|
|
Le plomb chez les Romains.
«
Des canalisations d’eau en plomb étaient assez courantes dans les
anciens jours et peuvent encore être présentes dans les vieux
bâtiments. Le plomb des conduites peut partiellement se dissoudre dans
l’eau circulante. Le plomb peut se lier au carbonate ; ainsi peu de
plomb se dissout dans une eau dure. À l’intérieur des conduites, une
couche de carbonate de plomb (PbCO3) très peu soluble se
forme. Cette couche fournit une couverture protectrice pour les
sous-couches de plomb des conduites. Les Romains remplissaient souvent
les conduites (en plomb) avec du vin lors des jours fériés, provoquant
la dissolution de la couche de carbonate de plomb et la formation de
sucre de plomb. Malgré sa toxicité, l’acétate de plomb (II) fut utilisé
longtemps au XIXe siècle comme édulcorant, pour adoucir le vin et
d’autres boissons.
À Rome, le plomb était souvent rejeté en tant que
produit intermédiaire de l’industrie minière de l’argent. La pollution
de l’eau contenant des composés au plomb dérivés de minerai de plomb
dans l’industrie minière fut tout d’abord mentionné par l’Architecte
Vitruvius, en 20 A.C., lorsqu’il a signalé des effets sur la santé,
connus aujourd’hui sous le nom de saturnisme. »
Relever dans le document ci-dessus les phrases évoquant uniquement un phénomène de passivation.
Cette couche de carbonate de plomb (PbCO3) fournit une couverture protectrice pour les sous-couches de plomb des conduites.
L’acide
acétique, appelé aussi acide éthanoïque, contenu dans le vin, provient
de l’oxydation de l’éthanol au contact de l’air et en présence d’une
bactérie acétique (acetobacter acéti Gram –).
Écrire l’équation de la transformation de l’éthanol en acide éthanoïque CH3COOH.
CH3-CH2OH + O2 ---> CH3-COOH + H2O.
Écrire la réaction équilibrée d’estérification de l’éthanol par l’acide éthanoïque. Nommer l’ester obtenu.
CH3-CH2OH + CH3-COOH =CH3-COO-CH2CH3 + H2O. L'ester est l'éthanoate d'éthyle.
L’ester
formé donne une odeur caractéristique de « piqué » pour des
concentrations en ester de 120 à 150 mg/L. Par ailleurs, l’acide
acétique et l’ester provoquent un « durcissement » du
vin même à très faible dose. Le vin contient de l’éthanol et un peu d’acide éthanoïque.
Cet acide réagit sur du carbonate de plomb en formant de l’acétate de plomb Pb(CH3COO)2 qui présente un goût sucré. Il se dégage par ailleurs du dioxyde de carbone.
Écrire la réaction de l’acide éthanoïque sur le carbonate de plomb.
PbCO3(s) +2CH3-COOH ---> Pb(CH3COO)2 + CO2 (g) +H2O.
Expliquer dans quel objectif « les Romains remplissaient souvent les conduites (en plomb) avec du vin lors des jours fériés ».
Les Romains remplissaient souvent les conduites (en plomb) avec du vin
lors des jours fériés, provoquant la dissolution de la couche de
carbonate de plomb et la formation de sucre de plomb.
Quel nom donne-t-on à la maladie liée à une intoxication au plomb ?
Le saturnisme.
|
|
|