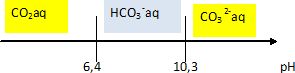|
|
Acido-bacisité
du dioxyde de carbone dissout.
Couples acide / base : CO2 aq / HCO3-aq
: pKa1~6 ; HCO3-aq/CO32-aq
: pKa2~10.
Disolution du dioxyde de carbone atmosphérique : CO2(g)
=CO2
aq.
Formation du calcaire en solution aqueuse : Ca2+aq
+CO32-aq= CaCO3(s).
pH moyen de l'eau de mer : 8,5.
Donner le
diagramme de prédominance des trois espèces.
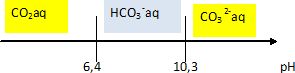
On relève sur l'étiquette d'une eau minérale les informations suivantes
: calcium 555 mgL ; magnésium 110 mg/L ; sodium : 14 mg/L ; sulfates :
1479 mg/L; hydrogénocarbonates : 403 mg/L ; nitrates : 3,9 mg/L ;
pH=7,0.
On peut s"tonner de ce que l'étiquettene mentionne pas la quantité
d'ions CO32-aq.
Quelle
est la masse des carbonates, en mg/L ?
HCO3-aq+H2O=CO32-aq
+H3O+aq.
Ka2
=[CO32-aq][H3O+] / [HCO3-aq] ;
[CO32-aq] =Ka2[HCO3-aq] /[H3O+] ~10-10
*403/10-7 ~0,4 mg/L
Dans une eau de pH neutre ou légèrement basique, on peut envisager la
réaction bilan :
2HCO3-aq=CO32-aq
+CO2aq+H2O.
L'ion
hydrogénocarbonate est donc un :
ampholyte ( vrai) ;( il peut se comporter comme un acide ou comme une
base )
oxydant ; réducteur ; acide fort. Faux.
Il y a lieu de penser que l'atmosphère primitive de notre planète était
riche en dioxyde de carbone ; d'autre part on observe de grandes
quantités de cyanobactéries fossiles. Les cyanobactéries marines
pratiquent la photosynthèse à partir du dioxyde de carbone dissout. Ces
constatations peuvent expliquer le fait que :
- le pH est acide, il y a apparition des ions CO32-aq
qui réagissent avec les ions Ca2+aq. Faux.
CO32-aq est majoritaire à pH >
10.
- le pH est basique,
il y a apparition des ions CO32-aq
qui réagissent avec les ions Pb2+aq. Faux.
- le pH est basique,
il y a apparition des ions CO32-aq
qui réagissent avec les ions Ca2+aq. Vrai.
- le pH est basique,
il y a apparition des molécules CO2 qui réagissent avec
les ions Pb2+aq. Faux.
|
|
|
Oxydoréduction. L'extraction
du pétrole s'accompagne de la libération de méthane ; l'exploitation
terrestre permet la récupération de ce gaz et son acheminement par
gazoduc, ce qui n'est pas possible à partir d'une plate-forme
d'exploitation off-shore. Aujourd'hui, le méthane ainsi libéré
s'échappe dans l'atmosphère. Pour diminuer les rejets de ce gaz qui
contribue à l'effet de serre, les pétroliers envisagent de le
recueillir pour le convertir en méthal, liquide plus facile à
transporter. le méthanol peut ensuite être utilisé en synthèse
organique. Il peut aussi servir de combustible thermique, ou alimenter
une pile d'oxydoréduction.
E°1(CO32-/CH3OH) =0,18 V à pH=0 ; E°2(H2O2/H2O) =1,78 V à pH=0 ; E°3(O2(g)/H2O2) =0,68 V à pH=0.
Le fonctionnement de la pile envisage l'oxydation du méthanol en carbonate.
Ecrire la demi-équation correspondante.
CH3OH +8HO-aq= CO32- +6e- +6H2O.
Pouquoi faut-il effectuer la réaction en milieu basique ?
Le CO2 est piégé sous forme de carbonate ; il ne se dégage pas dans l'atmosphère.
On réalise une pile utilisant des électrodes de platine, les " combustibles " étant le méthanol et le peroxyde d'hydrogène.
Que représente la borne Pt(CO32-/CH3OH) ?
Le méthanol s'oxyde : cette borne est une anode négative.
Quelle est l'autre demi-équation redox dans cette pile ?
Réduction de H2O2 en milieu basique : H2O2 aq +2e- = 2HO-.
Ecrire les potentiels de Nernst relatifs à ces deux demi équations.
E1 =E°1 +0,01 log([CO32-]/([CH3OH][HO-aq]8))
E2 =E°2 +0,03 log([H2O2 aq] /[HO-aq]2).
Ecrire l'équation traduisant le fonctionnement de la pile.
CH3OH +8HO-aq= CO32- +6e- +6H2O.
3H2O2 aq +6e- = 6HO-.
Ajouter : CH3OH +2HO-aq+3H2O2 aq = CO32- aq+6H2O.
Quelle est la valeur de sa constante d'équilibre ?
K = [CO32-]/([CH3OH][HO-aq]2[H2O2 aq]3).
A l'équilibre : E°1 +0,01 log([CO32-]/([CH3OH][HO-aq]8))=E°2 +0,03 log([H2O2 aq] /[HO-aq]2).
0,01 log([CO32-]/([CH3OH][HO-aq]8))-0,013 log([H2O2 aq]3 /[HO-aq]6) =E°2 -E°1.
log K =(E°2 -E°1)/0,01 =(1,78-0,18) / 0,01 =160 ; K = 10160.
|