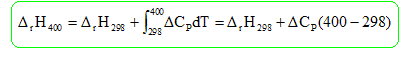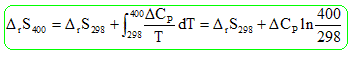Etude
thermodynamique de la synthèse de l'éthanol.
Concours CPR 2013
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
L'éthanol
fut d'abord un produit fabriqué par fermentation de divers composés
d'origine agricole. C'est seulement après la seconde guerre mondiale
que l'éthanol de synthèse supplanta l'alcool de fermentation. La
première unité utilisant le procédé d'hydratation directe fut démarée
par Shell en 1948. On fait réagir en phase gazeuse, de l'éthylène avec
de la vapeur d'eau pour produire de l'éthanol. Cette réaction conduit à
un état d'équilibre.
C2H4(g)+ H2O(g) = C2H5OH(g).
La constante d'équilibre associée à cette réaction est notée K°.
Quelle est la variance à l'équilibre ?
La variance est le nombre de paramètres intensifs indépendants.
La règle des phases donne la variance d'un système thermodynamique : v = c+2-j.
Le chiffre 2 indique le nombre de paramètres intensifs, température et
pression.
c : nombre de constituants indépendants ( nombre de constituants - nombre de
réactions chimiques indépendantes entre ces constituants)
Nombre de constituants : c=3 ; nombre de relation : 1 ; nombre de phase :
j=1, une seule phase gazeuse.
v = c-1+2-j= 3-1+2-1 =3.
Exprimer K° en fonction des pressions partielles.
K°=Péthanol P°/(PH2O Péthène).
Calculer l'enthalpie standard de la réaction à T1 = 400 K.
DrH°298
=DrH°(C2H5OH(g))
-DrH°(H2O(g))-DrH°(C2H4(g))
DrH°298
=
-235,1 +241,8-52,5 = -45,8 kJ / mol.
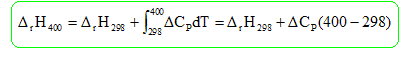
DCP
=65,4-33,6-43,6 = -11,8 J mol-1
K-1
DrH400
= -45,8 103 - 11,8*102
= -47,0
kJ/mol.
|
| .
. |
|
|
Calculer l'entropie standard de la réaction à 400 K.
DrS°298
=DrS°(C2H5OH(g))
-DrS°(H2O(g))-DrS°(C2H4(g))
DrS°298
=282,7-188,8-219,6
= -125,7 J mol-1
K-1
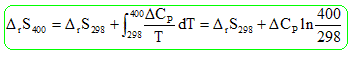
DrS°400
=-125,7
-11,8 ln (400 / 298) =
-129,2
J
mol-1 K-1.
Calculer la constante d'équilibre K1 à 400 K.
DrG°
=DrH°
-
TDrS°
=
-47,0 103 +400*129,2 = 4,67
103 J / mol.
De plus DrG°
=-RT
ln K1 ; ln K1 = 4,67
103/(-8,314*4008) = -1,404.
K1 =
0,246.
|
.
|
|
|
Les réactifs sont introduits en proportions
stoechiométriques. On appelle taux d'avancement
a, le nombre de moles
d'éthanol formé par mole
d'éthylène initial.
Relation entre K1,
a,
Ptot.
|
avancement (mol)
|
C2H4(g)
|
+ H2O(g)
|
=C2H5OH(g)
|
|
initial
|
0
|
n
|
n
|
0
|
|
à l'équilibre
|
x
|
n-x
|
n-x
|
x
|
A l'équilibre, nombre total de mol : N=2 n-x.
Fractions molaires :
|
xC2H4
=
|
n-x
2n-x
|
;
xH2O
=
|
n-x
2n-x
|
;
xC2H5OH
=
|
x
2n-x
|
Pressions partielles :
|
PC2H4
=Ptot
|
n-x
2n-x
|
;
PH2O
=Ptot
|
n-x
2n-x
|
;
PC2H5OH
=Ptot
|
x
2n-x
|
K1=x (2n-x)Ptot / (Ptot(n-x)2) avec a = x/n ; K1=a (2-a)Ptot / (Ptot(1-a)2).
Calcul de a
à 400 K sous Ptot = 1,00 bar.
0,246 ( 1-a)2 =
a(2-a)
; 1,246 a2-2,498
a+0.246 = 0 ; a
=0,104 ( 10,4
%).
Dans quel sens
l'équilibre précédent est
déplacé lors d'une élévation de
température à pression constante, le
système étant fermé.
DrH400
est négatif : la réaction est
exothermique.
Une élévation de température
favorise une réaction endothermique :
l'équilibre est déplacé dans le sens
indirect ( vers la gauche).
Dans quel sens
l'équilibre précédent est
déplacé lors d'une augmentation de
pression à température constante, le
système étant
fermé.
A l'équilibre, nombre total de mol : N=
2n-x.
Dans le sens direct, le nombre total de moles
diminue : une augmentation de pression à
température constante, favorise la
réaction qui conduit à une diminution
du nombre de moles.
Une augmentation de pression, à
température constante, déplace
l'équilibre dans le sens direct.
Expérimentalement on travaille
à 300 °C sous une pression de 70
bars.
Ces conditions
sont-elles en accord avec les prévisions
faites précédemment ?
La température proche de 573 K est
défavorable à l'équilibre,
mais il faut que les espèces soient gazeuse
sous une pression de 70 bars.
Une pression élevée déplace
l'équilibre dans le sens direct.
Les conditions expérimentales sont en
accord avec les prévisions faites.
|
|
|