Titrage de la
vanilline.
Concours technicien de la police scientifique Lille 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
Depuis
plus d'un siècle la vanilline est produite artificielllement
demi-longueur d'onde. La note du parfum est due à la molécule de
vanilline de formule : 4-hydroxy-3-méthoxybenzaldehyde. La vanilline
est un acide faible ( noté HVan/ Van-) de pKa =
7,4.
Dessiner
la molécule de vanilline.
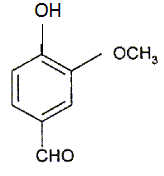
Le pH de la salive est de 7.
Quel est le rapport
[Van-] / [HVan] ?
pH=pKa + log([Van-]/[HVan]) ; 7 = 7,4 +log([Van-]/[HVan]) ;
[Van-]/[HVan] = 10-0,4
=0,398 ~0,4.
pH
d'une solution aqueuse de vanilline sous forme d'un sel basique à 0,1 M.
Ecrire
les différentes espèces chimiques qui s'établissent dans cette solution
aqueuse et calculer le pH de cette solution.
Na+,
HVan, Van-, H3O+, HO-.
|
avancement
volumique ( mol/L)
|
Van- |
+H2O
|
=HVan
|
+HO- |
initial
|
0
|
0,1
|
Solvant
|
0
|
0
|
à
l'équilibre
|
x
|
0,1-x
|
x
|
x
|
Ka = [Van-][H3O+] / [HVan] = [Van-]Ke / ([HVan][HO-])
Ka
/ Ke = (0,1-x) / x2 = 10-7,4 /
10-14 = 3,98 106.
3,98 106x2 =0,1-x ; 3,98 106x2 +x -0,1 = 0. Résoudre :
D = 1+4*0,1*3,98
106= 1,59 106 ; D½ =1,262 103.
x = (1+1,262
103) /(2*3,98 106) =1,59 10-4 ;
[H3O+] = 10-14 / (1,59
10-4)=6,3 10-11 ; pH =10,2.
|
| .
. |
|
|
Illégalement, un fabricant a
ajouté du sucre à la vanilline de synthèse, on cherche à déterminer la
quantité de sucre ajouté. Pour cela on va d'abord dissoudre le mélange
dans une solution de soude ( la vanilline étant soluble à pH basique )
puis doser la solution par l'acide chlorhydrique.
Dans une fiole jaugée de 100 mL on pèse 1 g de produit à analyser (
vanilline + sucre), on complète au trait de jauge avec une solution de
soude à 0,1 M. La masse de vanilline est négligeable par rapport au
volume de soude.
Ecrire l'équation de
la réaction qui se produit entre la vanilline et la soude.
HVan aq + HO-aq = Van-aq + H2O.
Calculer
la constante d'équilibre de cette réaction et vérifier qu'elle peut
être considérée comme totale.
K =[Van-aq] /([HVan aq][HO-aq])=Ka
/ Ke =10-7,4 / 10-14 = 3,98 106.
K est grand, la réaction est totale.
Montrer
que la soude est en excès par rapport à la vanilline.
n(soude) = 0,01 mol ; n(HVan) ~1 / M(vanilline) = 1/152 ~6,6 10-3
mol.
|
.
|
|
On
réalise un titrage pH-métrique du mélange ( vanilline / soude) par
l'acide chlorhydrique à 0,1 M. La prise d'essai du mélange est de 20
mL. Sur la courbe de titrage représentant le pH en fonction du volume
d'acide chlorhydrique ajouté, on obtient deux sauts de pH à 12 mL et à
18 mL.
Quel type
d'électrodes utiliseriez-vous pour mesurer le pH de la solution ?
L'électrode
de verre, électrode de mesure est sensible à la concentration aux ions
oxonium ; l'autre électrode sert de référence. L'électrode combinée
mesure Everre - Eréférence et traduit cette différence
en unité pH grâce à l'étalonnage préalable à partir de deux solutions
tampon étalon à températaure donnée.
On observe deux
sauts de pH.
Justifier
l'allure de la courbe.
Le premier saut
correspond au dosage de la soude en excès par l'acide chlorhydrique.
Le second saut correspond au dosage de la base faible Van-
par l'acide chlorhydrique.
Pour quel volume
'acide ajouté peut-on déterminer le pKa de la vanilline sur
la courbe de titrage. Justifier.
A la demi-équivalence du titrage acide fort base faible, le pH est égal
au pKa du couple (HVan / Van-).
Vacide = Véq1 +(Véq2-Véq1)
/ 2 = (Véq2+Véq1)
/ 2 = (12+18) / 2 = 15 mL.
Quel est la quantité
de sucre présent dans le mélange ( en % massique) ?
A la seconde équivalence : n(vanilline) = 0,1 *(18-12) 10-3
=6 10-4 mol dans la prise d'essai. Soit 5*6 10-4 = 3 10-3
mol dans la fiole jaugée de 100 mL.
Masse de vanilline m = 3 10-3
M(vanilline) = 3 10-3 *152 =0,156 g ~0,46 g dans 1 g de
mélange ( sucre vanilline).
% massique de sucre : 0,54 *100 = 54 %.
|
|
|
Solubilité de l'oxalate de calcium CaC2O4.
Un malade soufre de calcul rénal dont la masse est 0,284 g. Ce calcul
est composé uniquement d'oxalate de calcium. La dissociation de ce sel
dans l'eau libère des ions Ca2+ et C2O42-. Le produit de solubilité de l'oxalate de calcium est 3,6 10-9 à 298 K.
Calculer la solubilité de l'oxalate de calcium dans l'eau pure.
CaC2O4(s) = Ca2+aq +C2O42-aq.
Ks = [Ca2+aq][C2O42-aq] ; la solution étant électriquement neutre : [Ca2+aq]=[C2O42-aq].
[Ca2+aq]=Ks½ =(3,6 10-9)½ =6 10-5 mol/L.
Calculer la solubilité de l'oxalate de calcium dans une solution de sulfate de calcium à 0,1 mol/L.
On note x cette solubilité : Ks = [Ca2+aq][C2O42-aq] = (x+0,1) x.
x2+0,1x-3,6 10-9 =0. Résoudre :
D = 0,01+4*3,6 10-9 =1,00 000 144 10-2 ; D½ =1,000 000 72 10-1.
x = ½(-0,1 +1,000 000 72 10-1) =3,6 10-8 mol/L.
Quel serait le volume minimal d'eau pure pour dissoudre ce calcul ? M(CaC2O4) =128 g/mol).
n(calcul) = 0,284 / 128 = 2,22 10-3 mol.
Volume d'eau pure : 2,22 10-3 / (6 10-5)~37 L.
|
|
|
