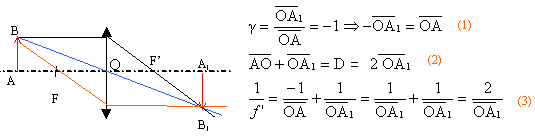Optique géométrique, électronique,
complexe du fer III. Concours dgccrf1 2010
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
Lentille
convergente.
Soit une lentille convergente L de centre optique O et un objet réel AB
de 1 cm de hauteur placé à 8 cm en avant de O. On obtient une image AB
réelle renversée, de même taille que l'objet, située 8 cm après O.
Placer
l'image A'B' ; construire deux rayons lumineux permettant de déterminer
les foyers principaux.
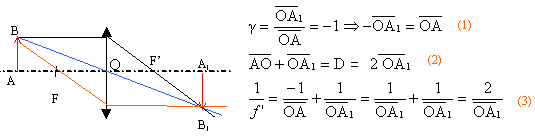
La relation (1) traduit le grandissement: le signe moins
indique que l'objet et l'image sont de sens contraire.
relation (2) : la distance objet image est notée D
relation (3) : formule de conjugaison des lentilles
pour conclure il suffit de remplacer OA1 par
½D, puis de prendre l'inverse des rapports égaux
d'où f
' = D/4 = (8+8) / 4 = 4 cm.
La
lentille précédente porte l'indication C = +25 dioptries.
Retrouver
par le calcul la distance focale.
f ' = 1 / C = 1 /25 = 0,040 m = 4,0 cm.
A'B' se situe 16 cm en avant du centre optique.
Déterminer par le
calcul les caractéristiques de l'image ainsi que la position de l'objet.
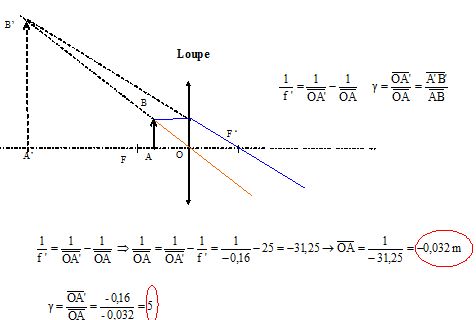
L'image est virtuelle, droite, plus grande que
l'objet. La lentille fonctionne en loupe.
|
| .
. |
|
|
Electronique.
On réalise le montage suivant :
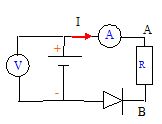
On mesure I = 0,5 A et le voltmètre indique U =
5,5 V. On retourne la diode, les appareils indiquent I = 0 et U = 6 V.
Calculer E et r.
Diode non passante : U = E = 6 V
Diode
passante U = E-rI ; r = (E-U) / I = (6-5,5) / 0,5 = 1 ohm.
|
.
|
|
Complexes du fer III.
On étudie deux complexes du fer : le thiocyanatofer III Fe(SCN)2+ et le fluofer III FeF2+.
Les réactions de formation de ces complexes sont :
Fe3+ + SCN- ---> Fe(SCN)2+. (1) pKD1 = 2,1.
Fe3+ + F- ---> FeF2+. (2) pKD2 = 5,5.
Le complexe Fe(SCN)2+donne
une coloration rouge en solution. Cette coloration n'est visible que
lorsque la concentration molaire de cet ion complexe est supérieure ou
égale à 3,2 10-6 mol/L.
Pour chaque complexe on donne une constante de dissociation appelée KD
définie comme l'inverse de la constante d'équilibre des équations
écrites ci-dessus. Soit 1 L de solution S contenant 0,1 mol de
thiocyanate de potassium et 5 10-4 mol d'alun ferrique [Fe2(SO4)3, K2SO4, 24 H2O].Quelles sont les concentrations molaires des différentes espèces de S à l'équilibre ? En déduire la couleur de S.
[K+] = 1,0 10-3 + 0,1 ~0,10 mol/L ; [SO42-] =2,0 10-3 mol/L.
L'ion thiocyanate est en large excès : [SCN-] ~0,10 mol/L.
KD1 = [Fe3+][SCN-] / [Fe(SCN)2+] =7,94 10-3.
[Fe3+] / [Fe(SCN)2+] =7,94 10-2.
Conservation de l'élément fer : [Fe3+] + [Fe(SCN)2+] =1,0 10-3.
[Fe(SCN)2+](1+7,94 10-2) =1,0 10-3. [Fe(SCN)2+] = 9,26 10-4 ~ 9,3 10-4 mol/L.
Par suite [Fe3+]=7,4 10-5 mol/L.
La solution S est rouge.
Soit
1 L de solution S', préparée par dissolution de 0,1 mole de thiocyanate
de potassium, 1 mole de fluorure de potassium et 5 10-4 mole d'alun ferrique dans de l'eau pure de manière à avoir 1 L de solution.
Expliquer qualitativement pourquoi cette solution n'est pas colorée en rouge.
Le complexe FeF2+( constante de formation 1 / 10-5,5 =3,16 105 ) est plus stable que le complexe Fe(SCN)2+ ( constante de formation 1/10-2,1 = 1,3 102). L'ion fer III est pratiquement entièrement sous forme FeF2+.
Calculer la concentration molaire de Fe(SCN)2+ dans S'.
La réaction (2) est prépondérante et l'ion fluorure est en large excès : [F-] ~1 mol/L.
KD2 = [Fe3+][F-] / [FeF2+] =3,16 10-6.
[Fe3+] / [FeF2+] =3,16 10-6 ; [FeF2+] ~1,0 10-3 mol/L et [Fe3+] =3,16 10-9 mol/L.
Puis l'ion fer (III) restant réagit avec l'ion thiocyanate.
L'ion thiocyanate est en large excès : [SCN-] ~0,10 mol/L.
KD1 = [Fe3+][SCN-] / [Fe(SCN)2+] =7,94 10-3.
[Fe3+] / [Fe(SCN)2+] =7,94 10-2.
Conservation de l'élément fer : [Fe3+] + [Fe(SCN)2+] =3,16 10-9.
[Fe3+](1 +1/(7,94 10-2 ) ) =3,16 10-9. [Fe3+] = 2,3 10-10 mol/L.
[Fe(SCN)2+] = [Fe3+] /7,94 10-2 ~ 2,9 10-9 mol/L.
|
|
|
Par
addition d'un acide fort à la solution, on provoque la réapparition de
la couleur rouge. On suppose que l'addition de l'acide fort se fait
sans variation de volume.
Quel est le pH de la solution lorsque la coloration réapparaît ?
HSCN est un acide fort ; HF / F- pKa = 3,2.
A l'apparition de la coloration rouge : [Fe(SCN)2+] =3,2 10-6 mol/L ; [Fe3+] = 7,94 10-2 *3,2 10-6 = 2,54 10-7 mol/L.
Conservation de l'élément fer : [Fe3+] + [Fe(SCN)2+] +[FeF2+] =1,0 10-3 mol/L.
[FeF2+] =1,0 10-3 -3,2 10-6 -2,54 10-7 = 9,965 10-4 mol/L.
Conservation de l'élément fluor : [HF] + [F-] + [FeF2+]=1,0.
[HF] + [F-] =0,999.
Constante d'acidité du couple HF / F- : 10-3,2 =6,3 10-4 =[H+][F-] / [HF] = [H+][F-] /(0,999-[F-]).
A l'équilibre [H+] =[F-].
6,3 10-4 = [H+] / (0,999-[H+]) ; 6,3 10-4 (0,999-[H+])= [H+]2 .
On pose x =[H+] : x2 + 6,3 10-4 x-6,3 10-4 = 0. Résoudre : [H+] = 2,48 10-2 mol/L ( pH =1,6).
Vérification :
105,5 = 3,16 105 = [FeF2+] / ([Fe3+][F-]) avec [FeF2+]~ 10-3 mol/L.
[Fe3+] =10-3 / (3,16 105 *2,38 10-2) =1,33 10-7 mol/L.
[Fe(SCN)2+] = [Fe3+] /7,94 10-2 ~ 2 10-6 mol/L.
|
|
|