La
vitamine C.
Bac S Polynésie 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
A propos de l'acide ascorbique
La formule topologique de l’acide L-ascorbique est représentée ci-dessous.
1.1.1.
Recopier la formule de l’acide L-ascorbique et identifier par un
astérisque * le (ou les) carbone(s) asymétrique(s). Justifier la
chiralité de cette molécule.
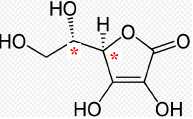
La molécule possède deux atomes de carbone asymétriques et aucun élément de symétrie : elle est donc chirale.
1.1.2.
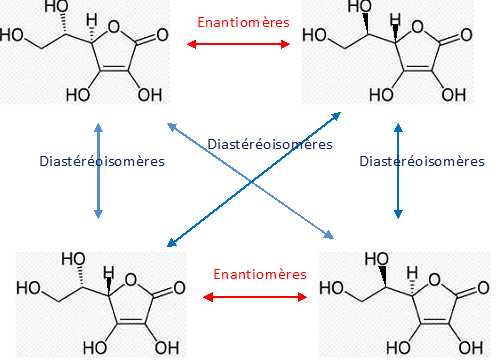
Représenter l’énantiomère de la molécule d’acide L-ascorbique. Cette
molécule possède-t-elle d’autres stéréoisomères ? Si oui, combien ?
Préciser les types de relation de stéréoisomérie qui les lie à l’acide
L-ascorbique.
Le spectre IR de l’acide L-ascorbique est reproduit ci-dessous.
1.2.1. Vérifier que le domaine de longueurs d’onde de ce spectre se situe bien
dans l’infrarouge.
Le spectre s'étale de 4000 cm-1 à 500 cm-1.
4000 cm-1 correspond à 1 / 4000 =2,5 10-4 cm ou 2,5 µm.
500 cm-1 correspond à 1 / 500 =2,0 10-3 cm ou 20 µm.
L'intervalle de longueur d'onde [2,5 µm ; 20 µm ] appartient au domaine IR.
1.2.2. Identifier, sur ce spectre, deux bandes d’absorption caractéristiques de l’acide L-ascorbique.
Pourrait-on distinguer le spectre IR de l’acide L-ascorbique de ceux des autres stéréoisomères de l’acide ascorbique ?
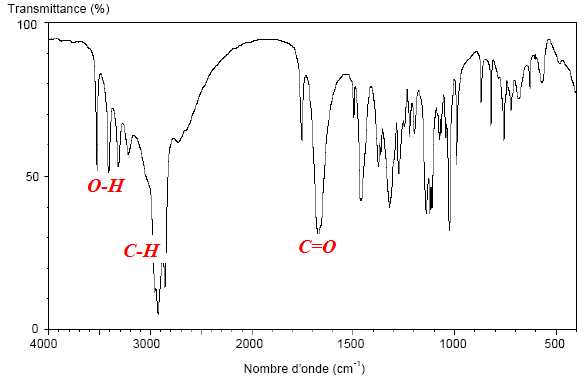
L'IR ne permet pas de distinguer les 4 isomères, car ils possèdent tous les mêmes groupes fonctionnels.
|
| .
. |
|
|
Une synthèse de la vitamine C.
La
vitamine C peut être obtenue à partir du D-glucose selon un procédé
chimique découvert en 1933, le procédé Reichstein décrit ci-après.
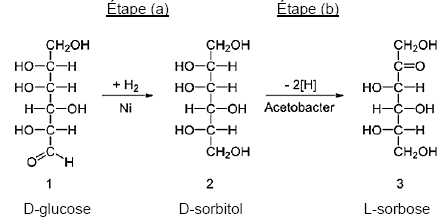
L’étape
(a) est l’hydrogénation du D-glucose en D-sorbitol à l’aide d’un
catalyseur, le nickel de Raney. L’étape (b) est l’oxydation par
fermentation microbienne du D-sorbitol en L-sorbose. Des étapes
ultérieures non détaillées ici permettent d’obtenir la vitamine C.
Le
nickel de Raney est un catalyseur solide utilisé dans de nombreux
procédés industriels. Constitué d’une fine poudre grise d’un alliage de
nickel et d’aluminium, il a été développé en 1926 par l’ingénieur
américain Murray Raney pour remplacer les catalyseurs utilisés à cette
époque dans l’industrie pour l’hydrogénation des huiles végétales. Il
est actuellement utilisé comme catalyseur hétérogène pour une grande
variété de réactions de la chimie organique, le plus souvent pour des
hydrogénations. D’après Wikipédia.
2.2.1. Recopier
la formule de la molécule de D-sorbitol et identifier un site donneur
de doublets d’électrons qui est concerné par la réaction chimique de
l’étape (b).
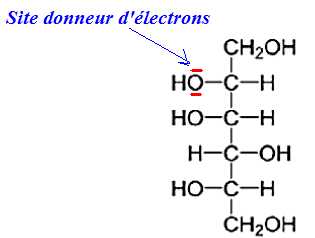
2.2.2. À quelle catégorie de réaction correspond cette étape ? Justifier. Quelle relation lie le D-glucose et le L-sorbose ?
L'oxydation de l'étape b est une élimination de 2 H. Deux liaisons simples sont remplacées par une liaison double.
Le
D-glucose est un aldehyde ; le L-sorbose est une cétone. Le groupe
carbonyle C=O occupe une position différente dans la chaine carbonée.
Ce sont deux isomères de position d'une fonction.
|
|
|
|
Analyse d’un comprimé de vitamine C.
Afin
de vérifier la quantité de vitamine C présente dans un comprimé à
croquer « Vitamine C 500 mg », le protocole suivant est proposé :
- réduire en poudre le comprimé dans un mortier ;
- verser l’intégralité du solide dans un erlenmeyer à l’aide d’eau distillée ;
-
réaliser le titrage colorimétrique du contenu de l’erlenmeyer par une
solution d’hydroxyde de sodium de concentration molaire Cb = 2,00 10-1 mol.L-1 et repérer le volume de solution d’hydroxyde de sodium versé à l’équivalence.
La réaction support du titrage de la solution de vitamine C par la solution d’hydroxyde de sodium a pour équation :
C6H8O6(aq) + HO–(aq) -->C6H7O6–(aq) + H2O(l).I
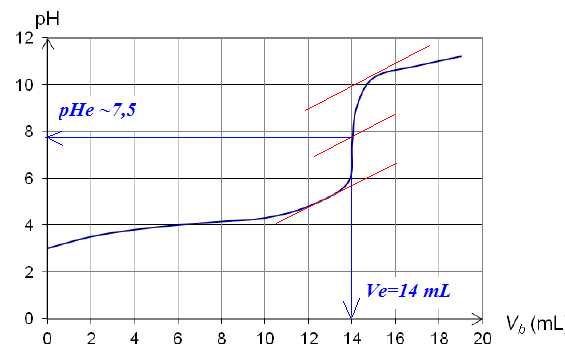
Il est possible de suivre ce titrage pHmétrie. La courbe alors obtenue a l’allure suivante :
Huit
titrages sont successivement réalisés dans un laboratoire d’analyse
afin d’augmenter la précision du résultat. Un tableau regroupe les
valeurs des différents volumes versés à l’équivalence :
| VBE(mL) | 14,1 | 14,2 | 13,8 | 14,3 | 14,0 | 14,3 | 14,1 | 14,2 |
3.1.
Proposer une méthode permettant de repérer visuellement l’équivalence
de ce titrage. Argumenter la réponse à l’aide des données et de vos
connaissances.
A l'équivalence, on observe un saut de pH important et la méthode des tangentes est utilisée à partir de la courbe.
Un indicateur coloré peut être utilisé. Sa zone de virage doit contenir la pH du point équivalent. Le BBT convient. La couleur de la solution est jaune avant l'équivalence et bleu après l'équivalence.
3.2. Les résultats expérimentaux sont-ils en accord avec l’indication du fabricant ?
Argumenter la réponse en l’appuyant sur un encadrement du volume de solution d’hydroxyde de sodium versé à l’équivalence.
VBE moyen = 14,1 mL ; écart type s = 0,17 mL ;
incertitude pour un niveau de confiance de 95 % : DVBE = 2 s / N½ = 2*0,17 / 8½ =0,12 mL
VBE moyen = 14,1 ± 0,1 mL.
A l'équivalence, quantité de matière d'acide ascorbique = quantité de matière de soude n= VBE Cb ;
n est compris entre : 13,98 *0,200 =2,796 mmol. et 14,22 *0,200 =2,844 mmol.
Masse molaire acide ascorbique M =176 g/mol.
La masse d'acide ascorbique dans un comprimé est comprise entre :2,796 *176 ~492 mg et 2,844*176 ~501 mg.
Les résultats expérimentaux sont en accord avec l'indication " vitamine C 500 mg".
3.3. Que pourrait-on envisager pour améliorer la précision du résultat de l’analyse.
On
pourrait augmenter la précision sur la détermination du volume équivalent
( effectuer un titrage avec suivi pHmétrique en réalisant un grand
nombre de petit ajout de volume de soude et faire tracer la courbe dpH
= f(VBE)).
- augmenter le nombre de titrages.
|
|