Autour
de l'acide lactique.
Bts biotechnologies 2015.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
I. Structure de l'acide lactique.
1.1. Entourer les groupes fonctionnels présents dans cette molécule et les nommer.
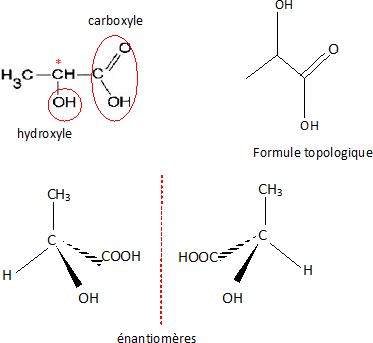
1.2.
Déterminer la géométrie autour des atomes de carbone portant les groupes fonctionnels.
L'atome de carbone porteur du groupe hydroxyle est tétragonal, de type AX4.
L'atome de carbone du groupe carboxyle est trigonal, de type AX3.
1.3. Identifier l'atome de carbone asymétrique présent en justifiant.
L'atome de carbone porteur du groupe hydroxyle est tétragonal et est lié à quatre atomes ou groupes d'atomes différents.
1.4. Donner la représentation de Fischer de l'acide (L)-lactique.
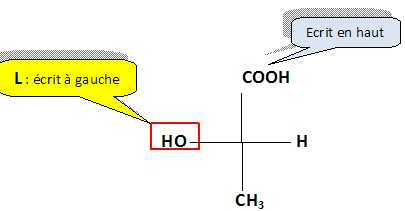 1.5. L'acide (L)-lactique est-il de configuration R ou S ? Justifier.
Numéroter de façon décroissante
chacun des quatre substituants selon son numéro
atomique.
1.5. L'acide (L)-lactique est-il de configuration R ou S ? Justifier.
Numéroter de façon décroissante
chacun des quatre substituants selon son numéro
atomique.
OH (1) ; COOH (2) ; CH3 (3) ; H (4).
On place alors l'atome (ou le groupement) de
numéro le plus élevé
derrière.
On regarde dans quel sens, sens horaire ou
trigonométrique, on passe du numéro 1, au 2,
au 3.
- Si le sens de rotation est le sens horaire (ou
anti-trigonométrique), le carbone est Rectus (R),
- Si le sens de rotation est le sens
trigonométrique (ou anti-horaire), le carbone est
Sinister (S).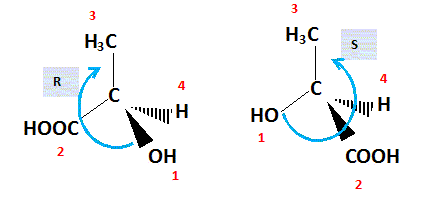 1,7. L'acide lactique obtenu par synthèse chimique conduit à un mélange racémique. Qu'appelle t-on mélange racémique ?
1,7. L'acide lactique obtenu par synthèse chimique conduit à un mélange racémique. Qu'appelle t-on mélange racémique ?
Un mélange racémique contient en proportion égale chacun des deux énantiomères de l'acide lactique.
|
| .
. |
|
|
II Synthèse du lactate d'éthyle.
2.1.
Ecrire l'équation de la réaction entre l'acide lactique et l'éthanol. A
quelle famille le composé organique formé appartient-il ?
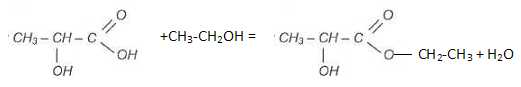
Le lactate d'éthyle est un ester.
2.2. Comment nomme -ton cette réaction ? Estérification .
2.3. Donner deux caractéristiques de cette réaction.
L'estérification est lente, limitée par l'hydrolyse de l'ester.
|
|
|
|
III. Synthèse de l'acide acrylique.
Cet acide peut être obtenu en chauffant l'acide lactique en présence d'acide sulfurique.
CH3-(CH(OH)-COOH --> H2O + C3H4O2.
3.1. De quel type de réaction s'agit-il ?
Elimination d'une molécule d'eau.
3.2. Donner la formule semi-développée du produit obtenu. H2C=CH-COOH.
3.3. Le produit obtenu est-il optiquement actif ? Justifier.
Le produit obtenu ne comporte pas de carbone asymétrique, il n'est pas optiquement actif.
3.4. Le produit existe t-il sous plusieurs formes diastéréoismères ? Justifier.
Non : l'un des carbones doublement liés à un autre carbone possède les mêmes atomes ( H2C=C< ). Donc, pas d'isomérie de type Z E.
IV. Synthèse de l'acide piruvique C3H4O3.
Dans
certaines conditions,l'acide (L)-lactique peut être oxydé en acide
pyruvique. Le spectre IR de l'acide lactique pésente entres autres
signaux, une bande large et intense entre 2500 et 3600 cm-1. Le spectre IR de l'acide pyruvique présente dans la même zone une bande moins intense et qui ne s'étend que de 2900 à 3200 cm-1.
4.1.
Quelle fonction est susceptible d'être oxydée lors de cette réaction ?
Les informations IR sont-elles en accord avec cette proposition ?
La
fonction alcool secondaire de l'acide (L)-lactique est oxydée en
cétone. Dans le spectre IR de l'acide pyruvique, la large bande intense
comprise entre 3200 et 3600 cm-1 a disparu. Elle correspondait au groupe OH de l'acide lactique, lié par liaison hydrogène.
4.2. Exploiter le spectre RMN de l'acide pyruvique pour proposer une structure de cet acide.
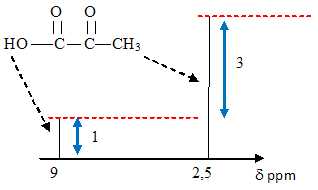
On observe deux groupes de protons ; les atomes de carbone voisins ne portent aucun proton, d'où l'existence de singulet.
|
|
|
|