Etude
cinétique de la formation de molécules prébiotiques.
Concours Capes 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
La
chimie prébiotique correspond à rétude de l'apparition de la vie du
point de vue de la chimie. Il a été montré que des solutions aqueuses
concentrées d'acide cyanhydrique HCN conduisent par polymérisation
à la production d'acides ou de bases nucléiques ainsi qu'à des acides
aminés alors que dans des solutions diluées c'est l'hydrolyse de HCN
qui prédomine pour donner en particulier de l'acide méthanoïque. Avec
des pH compris entre 8 et 9 et des températures comprises entre 0° et
60 °C, les deux réactions sont d'égale importance pour des
concentrations en HCN comprises entre 0,01 mol·L -1 et 0,1 mol· L -1.
Les
concentrations en HCN dans les océans primitifs ne sont pas estimées à
des valeurs aussi élevées mais une hypothèse de travail suggèrerait que
dans l'eau à 0°C, une polymérisation efficace pourrait être
obtenue même à partir de solutions en HCN très diluées.
Dans cette partie on s'intéresse à la cinétique d'hydrolyse de l'acide cyanhydrique HCN.
Une
étude a proposé que le mécanisme de cette hydrolyse est une réaction
directe entre l'acide cyanhydrique et l'ion hydroxyde de constante de
vitesse k2, et d'énergie d'activation Ea = 7,5 104 J . mol-1. Ce modèle conduit à une évolution du premier ordre de la concentration totale en cyanure [CNtotal]=[HCN]+[CN- ] selon une relation du type :
-d[CNtotal]/dt = k1[CNtotal] =k2(HCN] [HO- ]).
52. Montrer que la constante de vitesse k1 peut être exprimée par la relation :
k1 = k2KeC°2 / (KaC° +[H3O+] ).
Ke= [H3O+] [HO- ] / C°2 et Ka = [CN- ] [H3O+] / ([HCN]C°).
k1([HCN]+[CN- ]) =k2 [HCN] Ke C°2/ [H3O+].
k1(1+[CN- ] / [HCN] ) [H3O+] ) =k2 Ke C°2 ; k1 ( [H3O+] +KaC° ) =k2 KeC°2 ;
k1 =k2 Ke C°2/ ( [H3O+] +KaC° ).
La valeur de k1 a été mesurée à 100 °C et pH = 10,0.
On note t½ le temps de demi-réaction associé à la réaction de constante de vitesse k1.
On trouve k1 = 2,47 jour-1 et t½ = 0,28 jour.
On donne:
La concentration standard C° = 1,00 mol· L -1 ; pKe(100°C) = 11, 9 ; pKe(25°C) = 14, 0 ; pKe(0°C) = 14,9.
Le pKa du couple HCN/CN- varie avec la température comme indiqué sur la figure suivante :
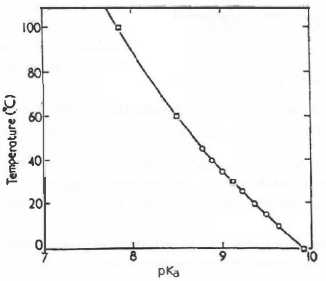
53. Sachant que la valeur de k2 ne dépend que de la température, calculer la valeur de k2 à 100°C. Déterminer la valeur de k1 à 100 °C pour un pH de 8,0.
k2 ne dépend que de la température ; à pH 10 et à 100°C :
k2 = k1( [H3O+] +KaC° ) / ( Ke C°2).k2 =2,47 (10-10 +10-8) / 10-11,9 = 1,98 104 L jour-1 mol-1.
A pH 8 et à 100°C :
k1 = k2KeC°2 / (KaC° +[H3O+] )= 1,98 104 *10-11,9 /(2 10-8)= 1,25 jour-1.
|
| .
. |
|
|
54. Donner la relation entre k1 et t½. En déduire le temps de demi-réaction t½ à pH =8,0.
.-d[CNtotal]/dt = k1[CNtotal] ; d[CNtotal] / [CNtotal] = -k1dt.
ln [CNtotal] = -k1t +cste ; à t=0, cste =ln [CNtotal]0.
ln( [CNtotal] / [CNtotal]0 )= -k1t.
A t½, [CNtotal] = 0,5 [CNtotal]0 ; ln2 =k1t½.
pH =8, t½ = ln2 /1,25 =0,55 jour.
55. Sachant que Ea = 7,5 104 J . mol-1, calculer la valeur de k2 à 0°C.
k2 = A exp(-Ea/ (RT) ) avec A = cste.
k2 (100°C )= A exp(-Ea/ (373 R) ; k2 (0°C )= A exp(-Ea/ (273 R) ;
k2 (0°C ) / k2 (100°C ) = exp(-Ea/ (273 R) / exp(-Ea/ (373 R);
k2 (0°C ) = k2 (100°C ) exp(Ea / R ( 1/373 -1/273)).
Ea / R ( 1/373 -1/273) = 7,5 104 / 8,314 (1 / 373-1 / 273)= -8,86.
k2 (0°C ) =1,98 104 exp (-8,86) =2,8 L jour-1 mol-1.
56. En déduire la valeur de k1 à 0°C et pH = 10,0 ainsi que t½ dans les mêmes conditions.
k1 = k2KeC°2 / (KaC° +[H3O+] )= 2,8 *10-14,9 /(2 10-10)=1,76 10-5~ 1,8 10-5 jour-1.
t½ = ln2 /(1,76 10-5)= 3,9 104 jour.
|
|
|
Réseau de courbes liant t½, la température et le pH.
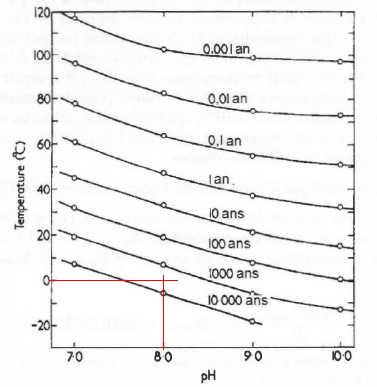
57. En utilisant la figure, estimer graphiquement le temps de demi· réaction t½ à 0°C pour pH = 8,0. 4000 à 5000 ans.
58. Indiquer de même sur la vitesse de la réaction d'hydrolyse de HCN :
- l'influence du pH à température constante ;
A température constante, t½ diminue si le pH augmente;
- l'influence de la température à pH constant,
à pH constant, t½ diminue si la température croît.
59. A partir de l'expression de k1, justifier l'influence du pH sur la vitesse d'hydrolyse de HCN à température constante.
k1 = k2KeC°2 / (KaC° +[H3O+] ).
A température constante, k2, Ke et Ka sont constants. [H3O+] intervient au dénominateur et pH = - log [H3O+].
A température constante, si le pH augmente, k1 croît.
60.
Commenter la phrase " Une hypothèse de travail suggèrerait que dans
l'eau à 0°C, une polymérisation efficace pourrait être obtenue même à
partir de solutions en HCN très diluées".
La constante de la réaction de polymérisation ( k2) ne dépend pas du pH et la constante de la réaction d'hydrolyse ( k1) diminue si le pH décroît, à température constante.
|
|
|