Synthèse de
l'aspirine, dosage des ions chlorure.
Concours ITRF Versailles
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Synthèse de
l'aspirine.
Trois classes de terminales de 36 élèves chacune réalisent cette
synrhèse en travaux pratiques ( groupes de 2 élèves).
La synthèsede l'aspirine est réalisée à partir de 36,2 mmol d'acide
salicylique et 7,0 mL d'anhydride éthanoïque en présence d'acide
sulfurique concentré ( 5 gouttes) et en chauffant le mélange au bain
marie durant 15 minutes à 60°C.
Faire cristalliser l'aspirine en laissant refroidir le mélange puis en
ajoutant lentement 70 mL d'eau froide.
Récupérer l'aspirine cristallisée. Conserver un peu de cete aspirine
non purifiée.
Pour faire face aux imprévus et aux erreurs éventuelles de manipulation
des élèves, on estime que 30 % de produit supplémentaire est nécessaire
au bon déroulement des séances de TP. Dans la réserve, 300 g d'acide
salicylique sont disponibles.
Calculer la masse d'acide salicylique nécessaire au bon déroulement des
TP.
M( acide salicylique) = 138 g/mol.
Nombre de groupes d'élèves : 36*3 / 2 =
54.
Quantité de matière
d'acide salicylique : 54 * 36,2 = 1954,8 mmol = 1,9548 mol.
Masse d'acide salicylique
: 1,9548*138 ~270 g.
270 *1,3 ~351 g. La réserve de ce produit est insuffisante.
Quel volume d'anhydride éthanoïque faut-il prévoir ?
54*7
=378 mL ; 378 *1,3 = 491 mL ~ 0,49 L.
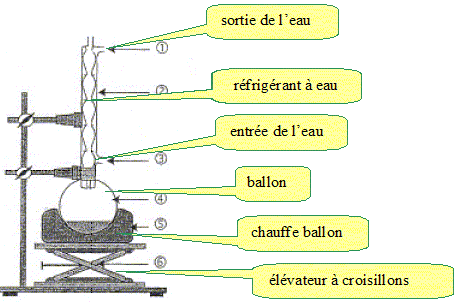
Quel système faut-il mettre en place, lors du chauffage au bain marie,
pour travailler en toute sécurité ?
Dispositif de chauffage à
reflux. Port de blouse, gants et lunettes de protection.
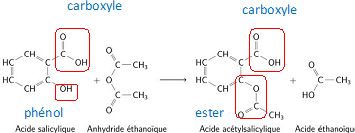
On donne l'équation de la
réaction de la synthèse de l'aspirine. Entourer et nommer le nom des
groupes fonctionnels présents sur les molécules d'acide salicylique et
d'acide acéthylsalicylique.
Un agent de laboratoire doit-il prendre les mêmes précautions avec
l'acide salicylique qu'avec l'acide sulfurique, pour quelles raisons ?
Dans les deux cas, port
de blouse, gants et lunettes de protection.
L'acide sulfurique
concentré est un acide fort beaucoup plus corrosif que l'acide
salicylique.
|
| .
. |
|
|
A
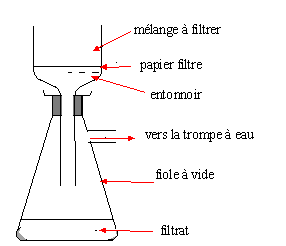
la fin de la synthèse, on fait précipiter l'aspirine en ajoutant de
l'eau froide au mélange. Quelle est la technique à utiliser pour
récupérer l'aspirine cristallisée ?
Filtration sous vide.
Pour
identifier l'aspirine ( température de fusion 140°C), on se propose de
mesurer la température de fusion du produit cristallisé sur banc
Koffler. Il s'agit d'une plaque chauffante présentant un gradient de
température sur lequel on déplace l'échantillon.
|
.
|
|
Dosage des ions chlorure.
Méthode de Mohr, dosage des ions chlorure présents dans un sérum physiologique, solution d'eau salée à 0,9 % en masse.
La solution titrante est le nitrate d'argent. Le chromate de potassium
joue le rôle d'indicateur coloré de fin de réaction. Le chlorure
d'argent est un solide blanc ; le chromate d'argent est un solide
rouge. Un volume V = 5,0 mL de la solution de sérum physiologique est
placé dans un erlenmeyer. On y ajoute 10 mL d'eau distillée et 10
gouttes de la solution aqueuse de chromate de potassium.
Que signifie sérum physiologique à 0,9 % ?
Dans 100 g, soit 100 mL de solution il y a 0,9 g de chlorure de sodium.
Décrire les changements de couleur et l'aspect du mélange réactionnel attendus au cours du titrage.
Avant l'équivalence l'ion argent est en défaut : on observe un précipité blanc de chlorure d'argent.
Un goutte de solution titrante après l'équivalence conduit à la précipitation du chromate d'argent rouge.
Le professeur demande le matériel suivant pour réaliser le
dosage : becher poubelle ; barreau aimanté ; erlenmeyer ; becher pour
verser les solutions ; compte gouttes ; éprouvette graduée ; poire à
pipeter. Trois éléments essentiels ont été oubliés. Lesquels ?
Butette graduée, pipette jaugée de 5,0 mL, agitateur magnétique.
Le professeur demande pour ce dosage une solution de nitrate d'argent
de concentration c = 0,050 mol / L. Donner le nom et la formule
chimique des ions présents dans la solution titrante.
Ion argent Ag+ et ion nitrate NO3-.
Chaque élève utilise un volume de solution aqueuse de nitrate d'argent
égal à 30 mL. Deux groupes de TP sont constitués chacun de 13 élèves.
Déterminer le volume total de solution de nitrate d'argent à préparer.
13 *2 = 26 élèves soit 26*30 = 780 mL = 0,78 L.
Nommer l'élément de verrerie utilisé pour préparer la solution. Fiole jaugée de 1,0 L.
Décrire le protocole de fabrication de cette solution à partir d'une solution mère de concentration c0 = 1,0 mol/L.
Facteur de dilution F = c0 / c = 1,0 / 0,050 = 20.
Prélever 1000 / 20 = 50
mL de solution mère et verser dans une fiole jaugée de 1,0 L. Rincer la
pipette jaugée à l'eau distillée. Compléter la fiole jaugée jusqu'au
trait de jauge avec de l'eau distillée. Agiter pour rendre homogène.
Donner la signifiaction des pictogrammes présents sur le flacon de nitrate d'argent.

Danger pour l'environnement ; comburant ; corrosif ; port obligatoire de gants et lunette de protection.
Indiquer le nom du bidon de recyclage dans lequel il faut verser la solution de nitrate d'argent.
Bidon réservé aux métaux lourds.
|
|
|