Chimie et
matériel.
Concours ITRF Evry 2013
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Structure de la matière.
Compléter le tableau.
Symbole de l'élément
|
Nom de l'élément
|
Nom de l'ion
|
Formule chimique
|
Na
|
Sodium
|
Ion sodium
|
Na+
|
K
|
Potassium
|
Ion potassium
|
K+
|
Au
|
Or
|
Ion sulfate
|
SO42-
|
Mn
|
Manganèse
|
Ion iodure
|
I-
|
Mg
|
Magnésium
|
Ion hydrogène
|
H+
|
Ag
|
Argent
|
Ion oxonium
|
H3O+
|
Cl
|
Chlore
|
|
|
Fe
|
Fer
|
|
|
Ecrire la formule chimique semi-développée des composés suivants :
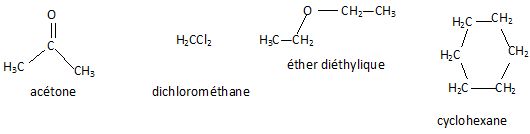
Donner la composition de l'atome 2311Na.
11 protons, 11 électrons, 23-11 = 12 neutrons, 23 nucléons.
A quelles familles appartiennent les éléments des deux dernières colonnes.
Halogènes et gaz nobles.
Réactions chimiques.
Que signifie les lettres dans pH ? Potentiel hydrogène.
Quelle est la relation liant le pH et la concentration en ion oxonium ? pH = -log [H3O+].
Calculer la concentration d'une solution d'acide chlorhydrique de pH=2. 10-pH = 10-2 mol/L.
|
| .
. |
|
|
On fait réagir de l'acide acétique CH3COOH avec de l'hydroxyde de sodium NaOH. Sur l'échelle des pKa ci-dessous, entourer les espèces réactives.
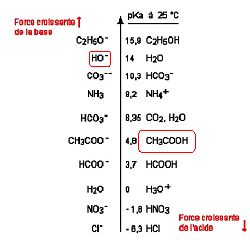
Ecrire l'équation de la réaction.
Na+aq + HO-aq + CH3COOH aq ---> CH3COO-aq + Na+aq + H2O(l).
|
.
|
|
Chimie organique.
A quelle catégorie appartiennent chacun des composés ?
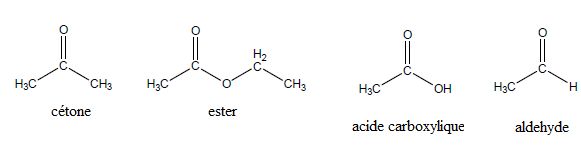
Comment appelle-t-on des molécules ayant la même formule brute mais des formules semi-développées différentes ? Isomères.
C2H6O : H3C--CO--CH3 et H3C--CH2--CHO.
Solutions et matériels.
Vous souhaitez neutraliser 310 mmol de NaOH avec une solution aqueuse d'HCl à 1 mol/L.
Déterminer les quantités mises en jeu pour préparer
1 L de solution d'HCl à 1 mol/L à partir d'une solution aqueuse d'HCl
concentré à 12 mol/L.
Facteur de dilution : 12 ; Volume de solution concentrée à prélever : 1000 / 12 =83,3 mL.
Pour préparer la solution, vous mettez :
l'eau dans l'acide ( faux), l'acide dans l'eau ( vrai).
Quel volume de la solution d'HCl à 1 mol/L faut-il utiliser pour neutraliser la soude ? V = 0,310 L = 310 mL.
Indiquer le nom du matériel et le type de d'utilisation.
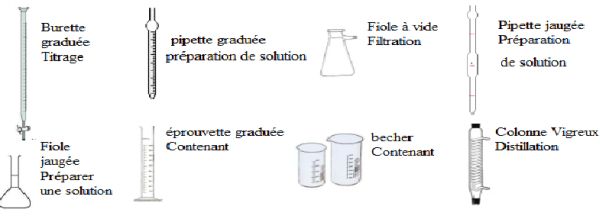
.
|
|
|