Chimie
organique ;
concours Fesic 1997.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
|
10.
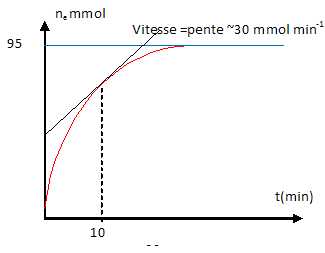
A la date t=0, on mélange 6g de propan-1-ol (M = 60 g/mol) et 37 g
d'acide propanoïque ( M' =74 g/mol). La courbe suivante donne la
quantité d'ester formé au cours du temps.
a.
La molécule de l'ester formé est chirale. Faux.
CH3-CH2-COO-CH2-CH2-CH3 ne possède aucun carbone asymétrique.
b. L'environnement VSEPR de l'atome de carbone fonctionnel est du type AX3E. Faux.
Carbone trigonal type AX3.
c. Le propan-1-ol est primaire. Le rendement de la réaction d'estérification est égal à 67 %. Faux.
n(alcool) = 6 /60 = 0,1 mol ; n(acide) =37/74 = 0,5 mol. L'acide est en large excès et le rendement sera supérieur à 67 %. .
d.
A la date t = 10 min, la vitesse d'estérification est environ 30 mmol / min. Vrai.
11. Synthèse de l'aspirine à partir du phénol.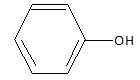
a. Le phénol est un alcool. Faux.
Le groupe OH n'est pas fixé sur un carbone tétragonal.
b.
L'anhydride éthanoïque est de l'acide éthanoïque pur, sans eau. Faux.
c.
La solubilité de l'aspirine est égale à 3,3 g/L 20°C.Pour
dissoudre entièrement un comprimé d'aspirine non effervescente marquée
"aspirine 500", il faut au moins 150 mL d'eau. Vrai.
0,5 g d'aspirine dans le comprimé ; volume minimal d'eau : 0,5 *1000 / 3,3 =150 mL.
d. Le passage du phénol à l'ion
phénate se fait avec un rendement de 80 %. Le passage du phénate de
sodium à l'acide salicylique se fait avec un rendement de 98%. La
dernière étape se fait avec un rendement de 100 %. Pour préparer 250 kg
d'aspirine, il faut 167 kg de phénol. Vrai.
M(phénol) = 94 g/mol ; M(aspirine) = 180 g/mol.
A partir de 94 g de phénol on obtient 180 g d'asprine si le rendement est de 100 %.
Rendement de la synthèse : 0,80*0,98 = 0,784.
Masse réelle d'aspirine : 180 *0,784 =141 g.
Puis 167 / 94 *141 =250kg.
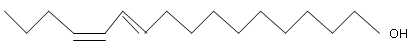
12. La phéromone sexuelle du Bombyx contient du bombykol.
a.
La masse molaire moléculaire du bombykol est 238 g. Vrai.
M(C16H30O)=16*12+30+16=238 g/mol.
b.
La molécule de bombykol possède une fonction alcool. Vrai.
c. La molécule de bombykol possède un atome de carbone asymétrique. Faux.
d. La molécule de bombykol appartient à une famille de 4 stéréoisomères. Vrai.2 liaisons doubles carbone-carbone ( isomérie Z / E).
13. On saponifie avec de la potasse KOH de la butyrine,triester du glycérol et de l'acide butanoïque.
a. La butyrine a pour formule semi-développée :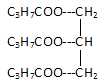 . Vrai. . Vrai.
b. La saponification de 1 g de butyrine nécessite 3,3 mmol de potasse. Faux.
M(butyrine) =15*12+26+6*16=302g/mol.
1/302 = 0,0033 mol = 3,3 mmol de butyrine. Il faudra 3*3,3 = 9,9 mmol de potasse.
c.
L'indice de saponification de la butyrine, nombre de miligrammes de
potasse nécessaires pour saponifier 1 g de butyrine, est voisin de 560. Vrai.
9,9 *M(potasse KOH) = 9,9 *(39+1+16)~560mg.
d. Dans laréaction de saponification, l'ion HO- a un comportement électrophile. Faux.
L'ion hydroxyde, riche en électrons, est nucléophile.
|
| .
. |
|
|
14. A un instant pris comme origine des temps,on mélange 20 mL de thiosulfate de sodium Na2S2O3 0,5 mol/L et 5 mL d'acide chlorhydrique 5 mol/L. On observe un troule qui s'intensifie au cours du temps.
2H3O+ + S2O32- ---> S +SO2 +3H2O.
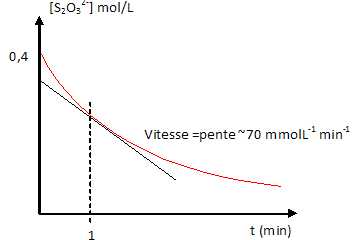
a. Le trouble est dû à la formation de SO2. Faux.
Le trouble est dû à la formation du soufre S.
b. Introduire un volume d'acide chlorhydrique supérieur à 5 mL augmente la vitesse initiale de la réaction. Vrai.
La concentration des réactifs est un facteur cinétique.
c. A t = 1 min, la vitesse de disparition des ions thiosulfate est 70 mmol / min. Vrai.
d. Il s'agit d'une réaction doxydoréduction. Vrai.
15. On introduit dans l'eau de la triméthylamine N(CH3)3 et de l'acide éthanoïque.
pKa(H+N(CH3)3 /N(CH3)3 ) =9,9 ; pKa(CH3COOH / CH3COO-) =4,7.
a. L'ion triméthylammonium H+N(CH3)3 est la base conjuguée de la triméthylamine. Faux.
H+N(CH3)3 est l'acide conjugué de la triméthylamine.
b. Les domaines de prédominance de la triméthylamine et de l'acide éthanoïque sont disjoints. Vrai.
c. La réaction entre la triméthylamine et l'acide éthanoïque est quasi-totale. Vrai.
La différence des pKa est voisine de 5
d. La constante de réaction entre la triméthylamine et l'acide éthanoïque est 105,2. Vrai.
N(CH3)3 + CH3COOH ---> H+N(CH3)3 +CH3COO-.
K =[H+N(CH3)3][CH3COO-] /([N(CH3)3][CH3COOH]) ;
K = [H+N(CH3)3][CH3COO-] [H3O+]/([N(CH3)3][H3O+][CH3COOH]).
K = Ka(CH3COOH / CH3COO-) / Ka(H+N(CH3)3 /N(CH3)3 ).
K = 10-4,7 / 10-9,9 = 105,2.
|
|
|
|
16. A
l'instant initial, on mélange : 95 mL d'acide sulfurique 0,100
mol/L, 3 mL d'acide oxalique 0,050 mol/L et 2 mL de permanganate de
potassium 0,025 mol/L. On suit l'évolution de la réaction àl'aide d'un
spectrophotomètre.
6H3O+ +2MnO4- +5H2C2O4---> 2Mn2+ +10CO2 +14H2O.
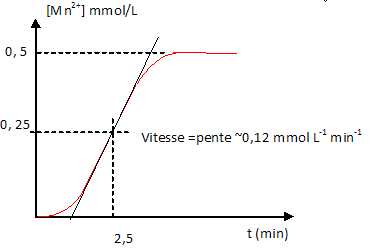
On recommence la réaction en ajoutant initialement une petite quantité de nitrate de manganèse, la décoloration est immédiate.
a. Le point d'équivalence est atteint à la date t = 2,5 min. Faux.
Le point d'équivalence est atteint lorsque [Mn2+] est constant.
b. C'est une réaction auto-catalysée. Vrai.
c.
La vitesse maximale d'apparition de l'ion manganèse est égale à 0,27 mmol L-1 min-1. Faux.
d. Lorsque la vitesse maximale est atteinte,la concentration des ions permanganate est 0,25 mmol/L. Vrai.
[Mn2+]=0,25 mmol/L. [MnO4-]initial =2*0,025 /100 =5 10-4 mol/L = 0,5 mmol/L.
Lorsque 0,25 mmol/L d'ion Mn2+ sont apparus, 0,25 mmol / d'ion MnO4- ont disparu.
17. On considère la
décomposition catalytique de 10 mL d'eau oxygénée à 20 volumes. On
rappelle qu'un litre d'eau oxygnée à 20 volumes se décompose en
dégageant V=20 L de dioxygène gazeux dans les conditions normales de
température et de pression. la catalyse est obtenue en versant 2 mL de
chlorure de fer (III) à 1 mol/L.
E°(H2O2/H2O)=1,77 V ; E°(O2/H2O2)=0,67 V.
a. La concentration initiale de l'eau oxygéné est 1,8 mol/L. Vrai.
H2O2 ---> H2O +½O2.
n(O2)=V / Vm = 20 / 22,4~0,9 mol ; n(H2O2) = 2 n(O2)=1,8 mol dans 1 L.
b. Les ions fer(III) sont catalyseurs de la réaction, donc le potentiel redox E°(Fe3+/Fe2+) est inférieur à 0,67 V. Faux.
E°(Fe3+/Fe2+) est compris entre E°(H2O2/H2O) et E°(O2/H2O2).
c. Au temps de demi-réaction, dans les conditions normales de température et de pression, il s'est dégagé 100 mL de dioxygène. Vrai.
Quantité maximale de dioxygène dégagé lors de la décomposition totale de 10 mL de cet eau oxygénée : 0,2 L = 200 mL.
Au temps de demi-réaction , il s'est dégagé 100 mL de dioxygène.
d.
Des ions Fe2+ se forment transitoirement au cours de la réaction. Vrai.
18. Hydrodistillation de l'écorce de petits citrons.
Il se forme du citral et du limonène 
a. Pendant toute la durée de l'hydrodistillation, le thermomètre indique une température supérieure à 100°C. Vrai.
b.
Dans le distillat recueilli, la phase organique est au dessus de la phase aqueuse.
Vrai.
La phase organique, la moins dense, occupe la partie supérieure.
c. La molécule de limonène possède un atome de carbone asymétrique.Vrai.
d. Pour vérifier la présence de limonène et de citral ans l'huile essentielle recueillie, on procède à une CCM.
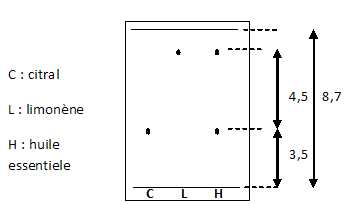
Les rapports frontaux du citral et du limonène valent respectivement environ 0,6 et 0,1. Faux.
RF citral =3,5 / 8,7 ~0,4 ; RF limonène =8 / 8,7 ~0,9.
19. Pour obtenir l'éthanamide on fait réagir de l'ammoniac en excès sur 7,85 g de chlorure d'éthanoyle.
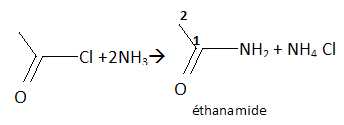
a. Il se forme 5,9 g d'éthanamide. Vrai.
n(chlorure d'éthanoyle) = 7,85 / (M(chlorure d'éthanoyle)=7,85 / 78,5 = 0,1 mol
n(éthanamide) = 0,1 mol soit 0,1 M(éthanamide) = 0,1*59 = 5,9 g.
b.
L'atome de carbone 1 est de type AX3. Faux.
L'atome de carbone 1 est trigonal, de type AX2.
c. L'atome d'azote a un environnement pyramidal. Vrai.
d. L'acétanilide 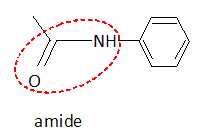 possède une fonction cétone. Faux. possède une fonction cétone. Faux.
20. On considère l'ester :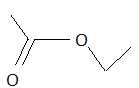
a. L'ester est le méthanoate d'éthyle. Faux.
L'ester est l'éthanoate d'éthyle.
b.
L'ester est obtenu par action de l'acide éthanoïque sur l'éthanol.
Vrai.
c. On mélange 60 g d'acide éthanoïque et 46 g d'éthanol. A l'équilibre on obtient 88 g d'ester. Faux.
A
partir d'une mole d'acide éthanoïque et une mole d'éthanol ( alcool
primaire) on obtient, à l'équilibre, 0,67 mol d'ester soit :
0,67 M(ester) = 0,67 *88 ~59 g.
d. La réaction d'estérification est athermique. La température est donc sans effet sur la vitesse de la réaction. Faux.
La température est un facteur cinétique : l'équilibre est atteint plus rapidement.
|
|
|
|