Les acides aminés.
Concours assistant d'ingénieur Reims 2012
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
|
1.a. Donner la configuration du carbone asymétrique de la cystéine.
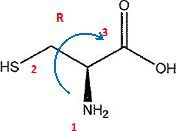
- Quelle est la signification du terme "a" dans acide a-aminé ?
Le groupe amino NH2 et le groupe carboxyle COOH sont portés par le même carbone..
- L'oxydation de la cystéine conduit à la cystine contenant le groupe disulfure. Proposer une structure pour la cystine.
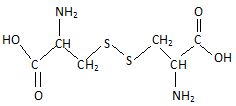 1.b. On considère les couples redox suivants :
1.b. On considère les couples redox suivants :
Cystine + 2e- +2H+= 2 cystéine E°1 = 0,08 V.
NAD+ +2e- +H+=NADH E°2 = -0,11 à pH =0.
On met en présence les quatre espèces Cystine, Cystéine, NAD+
et NADH dans une solution tamponnée à pH=0. Quelle réaction spontanée
se produit-il dans le cas où toutes les espèces sont initialement
égales à 1 mol/L ? Ecriver-la.
Réaction spontanée entre l'oxydant le plus fort ( Cystine) et le réducteur le plus fort (NADH) :
Cystine +NADH + H+---> 2 Cystéine + NAD+ .
- Calculer la constante d'équilibre de cette réaction spontannée.
K = [Cystéine]2 [NAD+] / ([Cystine][NADH][H+])
E1 = E°1 + 0,03 log ([Cystine][H+]2 / [Cystéine]2).
E2 = E°2 +0,03 log ([NAD+][H+] /[NADH] ).
A l'équilibre : E1 =E2
E°1 + 0,03 log ([Cystine][H+]2 / [Cystéine]2) =E°2 +0,03 log ([NAD+][H+] /[NADH] ).
log ([NAD+][H+] /[NADH] )-log ([Cystine][H+]2 / [Cystéine]2) =( E°1-E°2) / 0,03.
log K = (0,08+0,11) / 0,03 = 6,33 ; K =2,15 106.
1.c. A pH=0, on considère la solution suivante :
[Cystine]=[NADH]= 2 10-4 mol/L.
[Cystéine]=[NAD+]=0,5 mol/L.
- Calculer les potentiels initiaux des deux couples.
E1 = E°1 + 0,03 log ([Cystine][H+]2 / [Cystéine]2).
E1 = 0,08 + 0,03 log (2 10-4 / [0,52) =-0,013 V.
E2 = E°2 +0,03 log ([NAD+][H+] /[NADH] ).
E2 = -0,11 +0,03 log (0,5 /(2 10-4) ) = -0,0081 V.
Déduisez-en la constante K' de la réaction.
log K' = ( E1-E2) / 0,03=(-0,013+0,0081) / 0,03 = 6,33 ; K' ~0,68.
|
| .
. |
|
|
2. Selon la valeur du pH, les acides a-aminés peuvent prendre différentes formes ionisés.
- Donnez la structure de ces différentes formes ionisées.
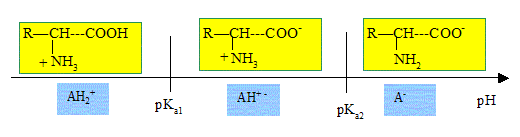
- L'une d'entre elle possède un caractère amphotère. Pourquoi ?
L'espèce notée H+ - peut se comporter comme un acide ou comme une base : elle a un caractère amphotère.
Les glutamates dérivent de l'acide glutamique ( acide 2-aminopentanedioïque ). On trouve dans les tables trois valeurs de pKa pour les couples dérivant de l'acide glutamique : pKa1 = 2,16, pKa2 = 4,15 et pKa3 = 9,58.
- Sur un axe gradué en pH représenter la forme acido-basique prédominante dérivée de l'acide glutamique en justifiant.
A pH < pKa1, les formes acides -COOH prédominent ; le groupe amine est sous forme NH3+.
A pH > pKa2, les formes -COO- prédominent ; à pH <pKa3, la forme NH3+ prédomine.
A pH > pKa2, les formes -COO- prédominent ; à pH >pKa3, la forme NH2 prédomine.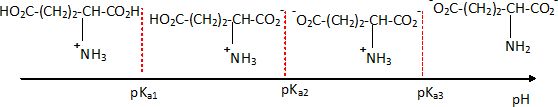
- Le pH initial d'une solution d'acide glutamique vaut pH = 7. Sous quelle forme se présente-t-il ?
-O2C-(CH2)2-CH(N+H3)-CO2-.
- Ecrivez l'équation de la réaction globale modélisant la
transformation lors du dosage de cette solution aqueuse à pH=7 par une
solution aqueuse d'hydroxyde de sodium.
-O2C-(CH2)2-CH(N+H3)-CO2- +HO- ---> -O2C-(CH2)2-CH(NH2)-CO2- +H2O.
|
|
|
|
c. On réalise le dosage d'une solution de lysine par une solution d'HCl de concentration C=0,1 mo/L
- Calculer le pHi de la lysine.
Le pHi d'un acide aminé est défini comme le pH pour lequel
la charge globale de cette molécule est nulle. Il se calcule en faisant
la moyenne des pKa qui entourent le domaine de prédominance de la structure électriquement neutre.
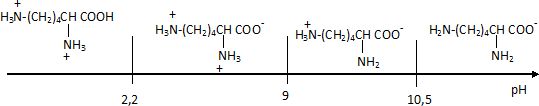
pHi = (9+10,5) / 2 =9,75.
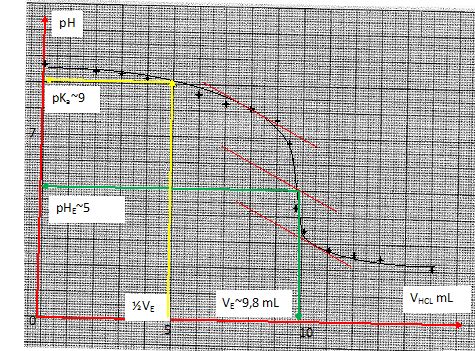
- Tracer la courbe pH = f(VHCl).
- A l'état initial sous quelle forme se trouve la lysine ?
A pH = 9,7 la forme prédominante est H3+N-(CH2)4-C(NH2) -COO-.
- Calculer la concentration de la solution de lysine si le volume de la prise est V = 20 mL.
A pH = pKa2 = 9
[lysine] V= CVE ; [lysine] = CVE / V = 0,1*9,8 / 20 = 0,049 mol/L.
- Donnez la forme et la concentration des espèces acides bases à la demi équivalence.
[H3+N-(CH2)4-C(NH2) -COO- ]=[H3+N-(CH2)4-C(N+H3) -COO- ].
Initialement, 0,049*20 = 0,98 mmol de lysine.
A la demi-équivalence : 0,49 mmol de chaque espèce dans environ 25 mL soit 0,0196 mol/L.
|
|
|
3. On souhaite effectuer la séparation de trois acides aminés par électrophorèse sur papier.
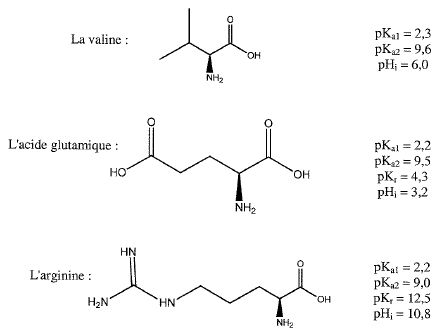
- Expliquer l'intérêt de travailler à pH=6.
La valine est sous forme (CH3)2CH- CH(N+H3)-COO-.
L'acide glutamique est sous forme -OOC- (CH2)2-CH(N+H3)-COO-.
L'arginine est sous forme H3+NC(NH)-HN-(CH2)3CH(N+H3)-COO-.
La valine ne bouge pas car son pHi est égal au pH de la solution
L'acide glutamique migre vers l'électrode positive (cathode) car son pHi est inférieur au pH de la solution.
L'arginine migre vers l'électrode négative ( anode) car son pHi est supérieur au pH de la solution.
A pH=14.
La valine est sous forme (CH3)2CH- CH(NH2)-COO-.
L'acide glutamique est sous forme -OOC- (CH2)2-CH(NH2)-COO-.
L'arginine est sous forme H2NC(NH)-HN-(CH2)3CH(NH2)-COO-.
La valine migre vers l'électrode positive (cathode) car son pHi est inférieur au pH de la solution.
L'acide glutamique migre vers l'électrode positive (cathode) car son pHi est inférieur au pH de la solution.
L'arginine migre vers l'électrode positive (cathode) car son pHi est inférieur au pH de la solution.
Les dépôts se feront près de l'anode négative.
A pH=1.
La valine est sous forme (CH3)2CH- CH(N+H3)-COOH.
L'acide glutamique est sous forme HOOC- (CH2)2-CH(N+H3)-COOH.
L'arginine est sous forme H3+NC(NH)-HN-(CH2)3CH(N+H3)-COOH.
La valine migre vers l'électrode négative ( anode) car son pHi est supérieur au pH de la solution.
L'acide glutamique migre vers l'électrode négative ( anode) car son pHi est supérieur au pH de la solution.
L'arginine migre vers l'électrode négative ( anode) car son pHi est supérieur au pH de la solution.
Les dépôts se feront près de la cathode positive.
|
|