QCM
: acide, alcool, composés organiques, dissolution, pile.
Concours kiné St Michel 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
|
|
|
|
|
|
|
1. Solutions acides et pH.
( 1 pt).
On considère les trois solutions suivantes, de même volume V = 20,0
mL,à 25°C.
La solution 1 est une solution d'acide chlorhydrique de pH1
= 3,0.
La solution 2 est une solution d'acide sulfurique de concentration c2
=0,5 10-2 mol/L.
La solution 3 est une solution d'hydroxyde de sodium de concentration c3
=0,5 10-2 mol/L.
- Pour la solution
2, pH2 = 2,3.
Faux.
L'acide sulfurique est un
diacide fort ; pH2 = -log (2c2)=-log
10-2 = 2.
-
L'ajout de 20 mL d'eau à la solution 1, conduit à une augmentation de
pH de 0,3 unité. Vrai.
pH'1
= -log (½c1) =log 2 -log c1
=0,3 +pH1.
-
Le pH de la solution 3 est gal à 11,7.
Vrai.
pH3
= 14 + log c3 = 14 + log(0,5 10-2)=11,7.
-
La
solution 3 provient d'une solution obtenue par dissolution d'une mase m
= 1,0 g de soude dans 500 mL d'eau.
Faux.
n = m / M(NaOH) = 1,0 / 40 =
0,025 mol ; c = n /V = 0,025 / 0,50 =0,050 mol / L.
2. Alcools.
(0,5 pt)
On considère les molécules organiques suivantes :
1. 2-méthylbutan-2-ol ; 2. 2,2-diméthylpropan-1-ol ; 
- La molécule 1 est
un alcool secondaire.
Faux.
Alcool
tertiaire.
-
La molécule 2 est plus soluble dans l'eau que la molécule 3.
Vrai.
La molécule
3 possède une plus grande chaîne carbonée hydrophobe. La solubilité est d'autant plus grande que la chaîne carbonée est plus courte et qu'il y a des ramifications.
-
La cohésion des alcools à l'état liquide est essentiellement
due à l'existence de liaisons hydrogène.
Vrai.
-
Le classement des températures d'ébullition des alcools ci-dessus est 2
< 1 < 3 < 4.
Faux.
La température d'ébullition croît avec le nombre de carbone et à nombre de carbone égal, diminue si la chaîne est ramifiée. 1 < 3 < 2 < 4.
3.
Composés
organiques. 0,5 pt.
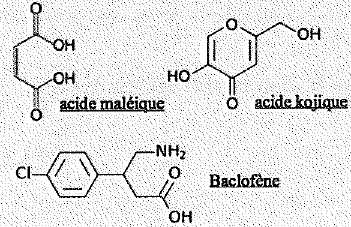
- Ces trois molécules comportent un groupe carboxyle. Faux.
L'acide
kojique ne comporte pas de groupe -COOH.
- Une seule de ces molécules est chirale. Vrai. ( le baclofène)
- Une de ces molécule présente l'isomérie Z / E. Vrai. ( l'acide maléïque )
- La réaction entre l'acide maléïque et l'acide kojique peut conduire à
la formation d'un ester.
Vrai.
|
| .
. |
|
|
4.
Nomenclature.
(0,5 pt)
- Le méthanoate de propyle et le propanoate de méthyle sont des
isomères.
Vrai.
H-COO-CH2-CH2-CH3
et CH3-CH2-COO-CH3.
- L'acide
2-amino-3-hydroxypropanoïque a pour formule brute C3H7NO3.
Vrai.
HOCH2-CH
NH2-COOH.
- 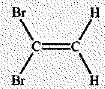 . Cette
molécule porte le nom de (Z)-1,1-dichloroéthène. Faux. . Cette
molécule porte le nom de (Z)-1,1-dichloroéthène. Faux.
1,1-dibromoéthène.
- 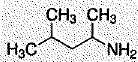 Cette molécule porte le nom de
1,3-diméthylbutylamine. Faux. Cette molécule porte le nom de
1,3-diméthylbutylamine. Faux.
2-amino-4-méthylpentane.
|
.
|
|
5. RMN et IR. 0,5 pt
.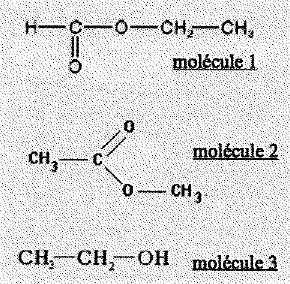
- La spectroscopie IR permet de distinguer les molécules 1 et 2. Faux.
- La
spectroscopie IR permet de distinguer les molécules 2 et 3. Vrai.
- Le spectre RMN de la molécule 2 comprend 2 singulets intégrant le
même nombre de protons. Vrai.
- Les spectres RMN des molécules 1 et 3 présentent un singulet, un
triplet et un quadruplet et sont donc identiques. Faux.
6. Dissolution (1 pt).
Le sel de Mohr est un solide de formule FeSO4,
(NH4)2SO4,
6H2O. On dissout du sel de Mohr dans 500 mL
d'eau afin d'obtenir une solution dont la concentration en sel de Mohr
est c = 2,0 10-2 mol/L. M( se de Mohr) 391,8
g/mol.
Les ions fer réagissent avec les ions hydroxyde pour former un
précipité d'hydroxyde de fer.
- Le sel de Mohr
est su solide moléculaire neutre.
Faux.
C'est un
solide ionique.
- Pour préparer
cette solution, il faut peser une masse m = 3,9 g de sel de
Mohr. Vrai.
n = c V = 0,020 *0,50 =0,010 mol
; m = nM = 0,010 *391,8 = 3,9 g.
- Le précipité d'hydroxyde de fer obtenu par ajout de quelques gouttes
d'hydroxyde de sodium à un prélevement de la solution a pour formule
Fe(OH)2 (s). Vrai.
- Dans la
solution, la relation entre les concentrations molaires des ions NH4+
et SO42- vérifient [SO42-]=[NH4+]=½c. Faux.
[SO42-] = 2 c ; [NH4+] = 2c .
7.
Pile.
0,5 pt.
Une pile est formée à partir des couples Cu2+/Cu
et Al3+/Al. les métaux sont en excès.les
solutions contenant les ions cuivre (II) et aluminium(III) ont la même
concentration. Le pont salin est constitué d'une solution saturée de
nitrate de potassium. Le courant circule de l'électrode de cuivre vers
l'aluminium à l'extérieur du circuit.
- A la borne négative : Al(s) ---> Al3+aq
+ 3e-. Vrai.
- Le pont salin
ferme le circuit électrique et assure le passage des électrons. Faux.
Les
électrons se déplacent dans les métaux, pas dans les électrolytes.
- La cathode est constituée par le cuivre. Vrai.
- L'équation de
fonctionnement de la pile est 3Cu(s) + 2Al3+aq
---> 3 Cu2+aq + 2Al(s). Faux.
3
Cu2+aq + 2Al(s)--->3Cu(s) + 2Al3+aq.
|
|
|