Extraction de la
bauxite. Bac S
Liban 2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
|
La
bauxite est une roche dont le nom provient du village des
Baux-de-Provence où elle a été découverte. Elle contient différents
oxydes dont la silice de formule SiO2 et l'alumine de formule Al2O3
utilisée pour la fabrication de l'aluminium. Le procédé de production
industrielle de l'alumine le plus utilisé aujourd'hui est le procédé
Bayer Il fut mis en oeuvre dès 1894 par différentes usines situées dans
le sud de la France. Il est basé sur l'attaque de la bauxite par de la
soude.
Questions préliminaires :
1. Quelle est la
réaction, support du titrage, mise en oeuvre pour déterminer la
concentration de la solution de soude utilisée pour le traitement de la
bauxite ?
On réalise au préalable une dilution au dixième de la solution de soude utilisée dans le procédé.
Puis on procède au titrage acido-basique, suivi par conductimétrie,
d'un volume de 5,0 mL de solution diluée de soude par de l'acide
chlorhydrique (H3O+(aq) + Cl- (aq)) de concentration molaire 0,50 mol.L-1.
H3O+(aq) +HO-aq --> 2H2O(l).
2.
En déduire la concentration molaire de l’hydroxyde de sodium dans la
solution de soude utilisée lors de la mise en oeuvre du procédé Bayer.
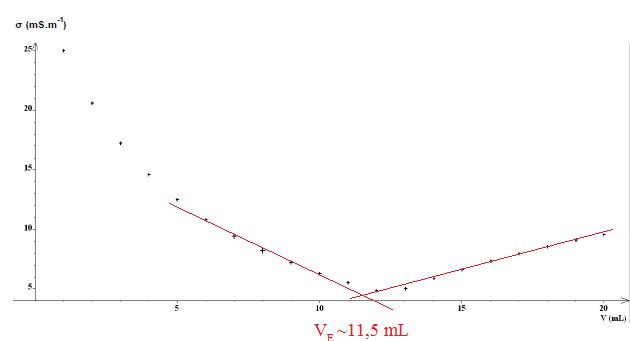
A l'équivalence, quantité de matière de soude n = 0,50 *11,5 ~5,8 mmol dans 5,0 mL.
Concentration de la solution diluée de soude : 5,8 / 5,0 =1,16 ~1,2 mol/L.
Tenir compte de la dilution au dixième : 12 mol/L.
|
|
|
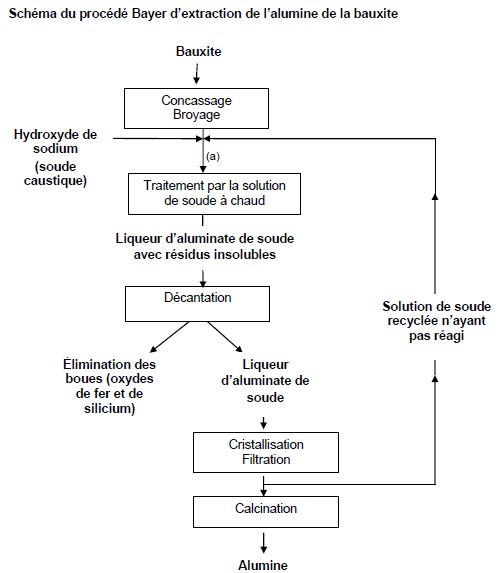
Après broyage, la bauxite est attaquée à chaud, sous pression, par une
solution de soude, ce qui permet d’obtenir une liqueur d’aluminate de
soude avec des résidus insolubles en suspension. Cette liqueur est
ensuite décantée : les oxydes de fer et de silicium forment une boue
rouge, chimiquement inerte, qui est évacuée vers un site de déversement
approprié. La liqueur restante est renvoyée dans des décomposeurs pour
précipitation de l’alumine, qui est ensuite récupérée par filtration et
calcinée.
La solution de soude non utilisée est renvoyée dans le réacteur dans
lequel on rajoute de la soude solide afin de maintenir la concentration
en soude constante. Les besoins en soude solide correspondent :
- à la soude nécessaire à la réaction ;
- à la soude perdue lors du procédé notamment dans les boues (estimées
à 2,5 % de la masse de soude utilisée pour le traitement de la bauxite).
Données techniques du procédé Bayer :
- pourcentage massique en alumine dans la bauxite : 50 % ;
- débit massique de bauxite : 10 kg.h-1 ;
- débit volumique de la solution de soude utilisée pour le traitement de la bauxite: 338 L.h-1.
On considère ce débit comme constant au point (a).
|
|
|
|
Problème :
Pour une heure de traitement de bauxite en continu, quelle masse
d’hydroxyde de sodium solide faut-il introduire dans le réacteur afin
de maintenir la concentration de la soude constante ?
L'analyse des données et des documents ainsi que la démarche suivie
seront évaluées et nécessitent d'être correctement présentées. Une
analyse critique des résultats est attendue.
Pour une heure de fonctionnement :
Masse d'alumine : 5,0 kg ; M(alumine) = 2*27 +3*16 = 102 g/mol.
Quantité de matière d'alumine : 5,0 103 / 102 ~49 mol.
La transformation de l’alumine par la solution de soude peut être modélisée par la réaction d'équation suivante :
Al2O3(s)+ 2 HO- (aq) + 3 H2O(l) -->2 [Al(OH)4]- (aq).
Quantité de matière de soude nécessaire à la réaction : 49*2 = 98 mol.
M(NaOH) = 40 g/mol ; masse de soude : 98*40 =3921 g ~3,9 kg.
Masse de soude injectée au point (a) : 338 L soit 338*12 = 4056 mol soit 4056*40 ~1,6 105 g = 1,6 102 kg.
Masse de soude perdue dans les boues : 1,6 102 * 2,5 / 100 = 4,0 kg.
Masse totale de soude utilisé : 3,9 +4,0 ~8,0 kg.
La soude est en grand excès.
Masse de soude non utilisée : 160 -8,0 = 152 kg.
Il est indispensable de recycler l'excès de soude.
|
|