Vanille et
vanilline. Bac S Nlle Calédonie 2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
|
La
gousse de vanille est le fruit d'une orchidée grimpante; cette plante
s'attache aux branches des arbres à l'aide de racines aériennes et peut
atteindre 100 m de long. Les gousses de vanille de la Réunion, de
Madagascar et de Tahiti sont réputées.
La vanille naturelle développe un parfum complexe formé de plusieurs
centaines de composés aromatiques différents. La note dominante de
l'arôme de la vanille naturelle est donnée par la molécule de vanilline
ou 4-hydroxy-3-méthoxybenzaldéhyde, de formule brute C9H902 .
Dans cet exercice, on se propose d'étudier la réactivité de la vanilline, puis une technique d'analyse
permettant de doser la vanilline dans un sucre vanillé.
1. La vanilline, molécule polyfonctionnelle.
La vanilline est un composé polyfonctionnel qui présente beaucoup
d'intérêt en chimie organique. Elle permet entre autres de produire
l'alcool vanillique et l'acide vanillique.
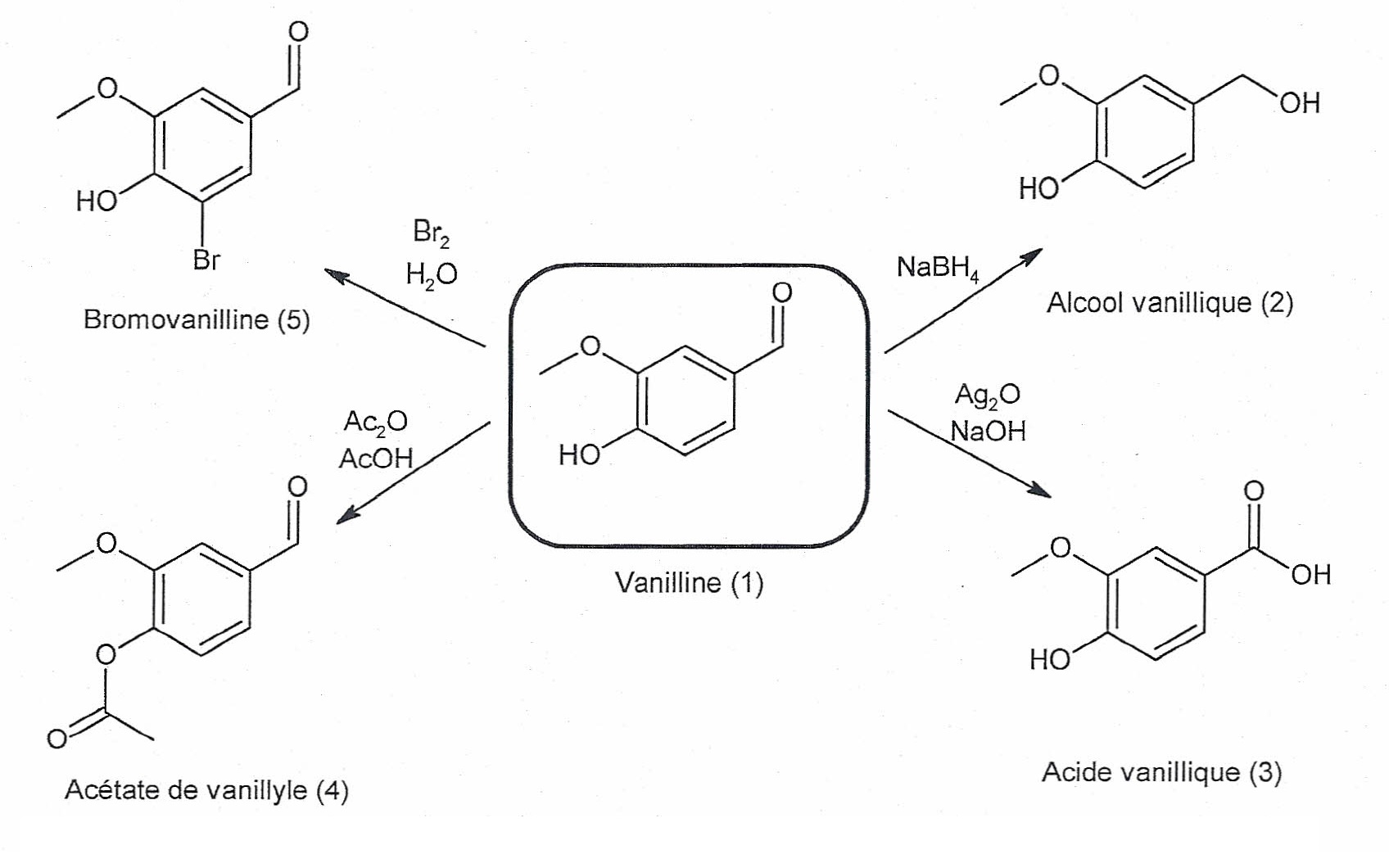
1.1. Indiquer pour
chacune des réactions de synthèse des composés (2) et (5) s'il s'agit
d'une réaction d'addition, d'élimination ou de substitution. Justifier
brièvement.
Synthèse du composé 2 : réaction d'addition sur une double liaison ; réduction d'un aldehyde en alcool primaire.
Synthèse du composé 5 : réaction de substitution d'un hydrogène du noyau benzénique par un atome de brome.
1.2. La réaction
conduisant à l'alcool vanillique (2) correspond-t-elle à une
modification de chaine ou de groupe caractéristique? Justifier.
Le squelette carboné n'est pas modifié. La fonction aldehyde CHO est modifiée, passage à une fonction alcool primaire -CH2OH.
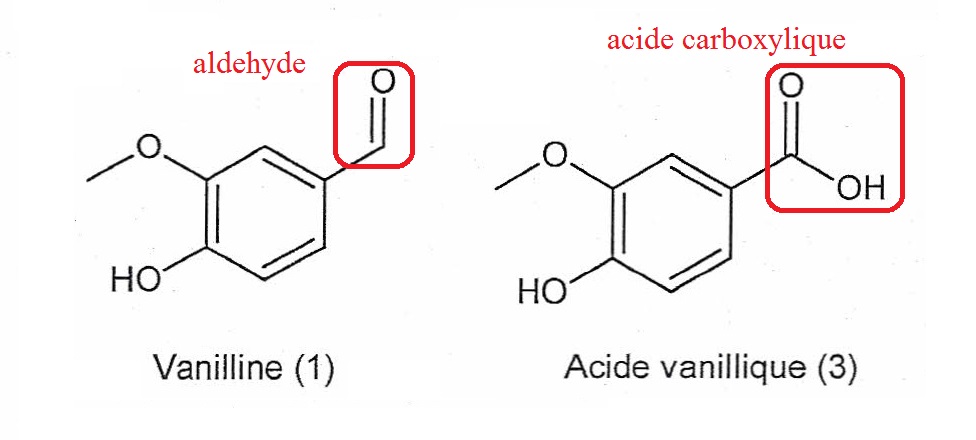
1.3. On s'intéresse
à la réaction permettant de passer de la vanilline (1) à l'acide
vanillique (3). Recopier les formules de la vanilline (1) et de l'acide
vanillique (3). Pour chacune de ces molécules, entourer le groupe
caractéristique modifié et indiquer le nom de la fonction chimique
associée.
On se propose d'étudier la synthèse de la vanilline (1) en alcool vanillique (2) par le borohydrure de sodium NaBH4. la réaction, qui libère de l'énergie, est réalisée par les ions hydrure H- apportés par NaBH4 en excès. les ions H30+ sont également introduits en excès.
Le protocole expérimental de la synthèse est le suivant.
• Dans un ballon bicol, introduire 3,00 g de vanilline.
• Adapter un réfigérant à eau.
• Dissoudre la vanilline dans 30 ml de solution aqueuse d'hydroxyde de sodium (Na+(aq) + HO-(aq))
de concentration molaire voisine de 1 moI.L-1..
• Agiter pour obtenir une solution homogène et refroidir au moyen d'un bain de glace.
• Ajouter 900 mg de borohydrure de sodium par petites portions en maintenant l'agitation.
• Une fois le borohydrure de sodium ajouté, retirer le bain de glace et laisser sous agitation, à
température ambiante, pendant 30 min.
• Refroidir ensuite à 0 °C et ajouter progressivement quelques millilitres d'une solution d'acide
chlorhydrique (H30+ (aq) + CI- (aq)) de concentration molaire voisine de 2,5 rnol.L-1.
• Récupérer le précipité d'alcool vanillique obtenu par filtration sur Büchner et le laver deux fois avec
de l'eau glacée.
• Purifier l'alcool vanillique obtenu par recristallisation.
• Sécher l'alcool vanillique purifié en le plaçant une heure à l'étuve (enceinte chauffée).
La réalisation de ce protocole a permis de synthétiser 2,29 g d'alcool vanillique.
|
|
|
1.4. Justifier l'utilisation d'un réfrigérant à eau sur le ballon bicol.
La réaction de réduction libère de l'énergie. Les vapeurs se condensent
dans le réfrigérant à eau et retombent dans le milieu réactionnel : on
évite les pertes de matière.
1.5.
Représenter sur un axe des pH les domaines de prédominance du couple
acide-base de la vanilline. On notera HVan la vanilline et Van- sa base conjuguée. Pourquoi ajoute-t-on une solution aqueuse d'hydroxyde de sodium pour dissoudre la vanilline ?
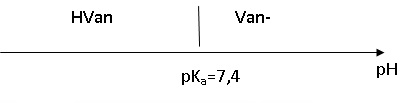
Sous la forme HVan la vanilline est peu soluble dans l'eau. La forme Van-, majoritaire en milieu basique, est très soluble dans l'eau.
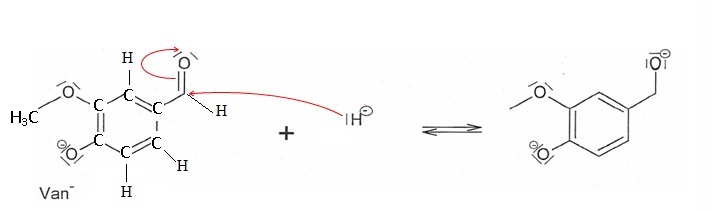
1.6.
Une des étapes du mécanisme simplifié de la synthèse de l'alcool
vanillique est présentée ci-dessous. Écrire la formule développée de Van-
Recopier l'étape du mécanisme et relier par des flèches courbes les sites donneurs et accepteurs
d'électrons.
1.7. Justifier l'ajout d'acide chlorhydrique en excès après le refroidissement à 0 °C du mélange réactionnel.
L'alcool vanillique AVan est peu soluble dans l'eau sous sa forme acide. Cette forme prédomine à pH inférieur au pKa ( 9,8). Il précipite, ce qui permet de le séparer du milieu réactionnel par filtration.
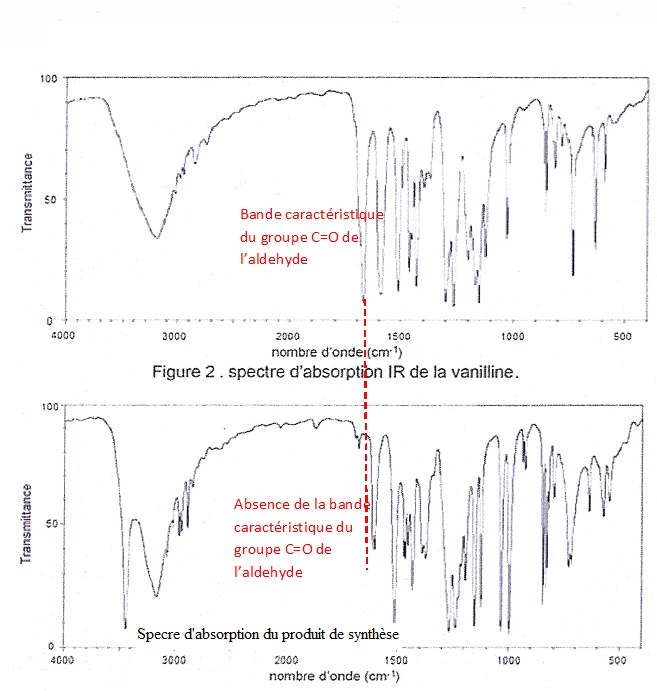
1.8. Les spectres
d'absorption infrarouge de la vanilline et du produit de synthèse
obtenu sont donnés ci dessous(figure 2 et figure 3). Vérifier que la
vanilline a été consommée lors de la réaction réalisée.
1.9. Déterminer la valeur du rendement de la synthèse.
Quantité de matière de vanilline, réactif limitant : m / M(vanilline) = 3,00 / 152mol
Dans l'hypothèse d'une réaction totale, on peut espérer obtenir au
mieux 3,00 / 152 mol d'alcool vanillique soit 3,00 / 152 x 154 = 3,04 g.
Rendement : masse expérimentale / masse théorique = 2,29 / 3,04 = 0,753 (75,3 %).
|
|
|
|
2. Dosage spectrophotométrique de la vanilline dans un sachet de sucre vanillé.
Sur
l'étiquette du sachet de sucre vanillé, il est précisé l'information
suivante: « 4 % en masse de gousse de vanille ». On souhaite vérifier
cette information.
Protocole de préparation de la gamme étalon.
• Dans une fiole jaugée de 1 ,00 L, introduire 100 mg de vanilline pure.
•
Dissoudre complètement la vanilline et compléter jusqu'au trait de
jauge avec une solution aqueuse d'hydroxyde de sodium. On obtient une
solution mère notée F0.
• Dans une fiole jaugée de 100,0 ml, introduire 1,00 ml de F0 et compléter jusqu'au trait de jauge avec la solution d'hydroxyde de sodium. On note F1 la solution fille obtenue.
• Préparer de même des solutions filles F2 à F6 en prélevant respectivement des volumes égaux à 2,0 ; 3,0 ; 4,0 ; 5,0 et 6,0 ml de F0.
•
Mesurer l'absorbance A des six solutions pour une longueur d'onde de
348 nm. À cette longueurd'onde, seule la vanilline absorbe.
Protocole de préparation de l'échantillon de sucre vanillé.
• Dans une fiole jaugée de 500 ml, introduire 1,0 g de sucre vanillé.
• Dissoudre complètement le sucre et compléter jusqu'au trait de jauge avec la solution d'hydroxyde de sodium.
• Mesurer l'absorbance de la solution de sucre vanillé pour une longueur d'onde de 348 nm.
Résultats expérimentaux.
Solutions filles
| F1
| F2
| F3
| F4
| F5
| F6
| sucre vanilé
| Concentration ( µmol/L)
|
| 13
| 20
| 26
| 33
| 39
|
| Absorbance A
| 0,175
| 0,342
| 0,510
| 0,670
| 0,851
| 1,020
| 0,241
|
D'après La chimie expérimentale (Chimie organique et minérale)
Romain BARBE, Jean-François LE MARÉCHAL - Edition 2007 DUNOD
2.1. Montrer que la concentration de la solution mère F0 est de 6,6 x 10-4 rnol.L-1 puis en déduire la concentration de la solution fille F1.
Dans un litre : F0 : m / M(vanilline) =0,100 / 152 = 6,6 x 10-4 rnol.L-1.
F1 : facteur de dilution : 100 / 1 = 100 ; concentration de la solution F1 : 6,6 x 10-4 r/*100 = 6,6 10-6 mol L-1 = 6,6 µmol L-1.
2.2. Montrer à l'aide des résultats expérimentaux que la masse de vanilline présente dans 1,00 g de sucre
vanillé est d'environ 0,7 mg.
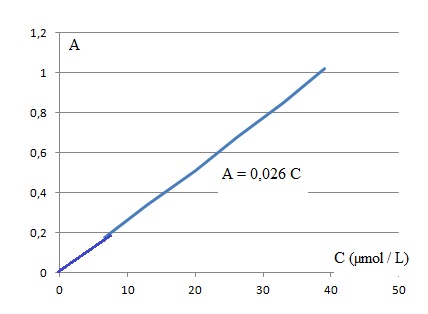
Concentration de la vanilline dans le sucre vanilé : 0,241 / 0,026 = 9,27 µmol L-1.
Soit 0,5 x 9,27 = 4,63 µmol ou 4,63 x152 = 704 µg ~ 0,7 mg dans 1 g de sucre vanilié.
2.3.
Sachant qu'un gramme de gousse de vanille peut contenir de 5 à 25 mg de
vanilline, vérifier si la mention sur l'étiquette est acceptable.
Un gramme de gousse de vanille contient entre 0,5 % et 2,5 % de vanille.
L'indication de l'étiquette n'est pas acceptable.
|
|