QCM chimie.
Concours kiné Ceerrf 2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
Question 1.
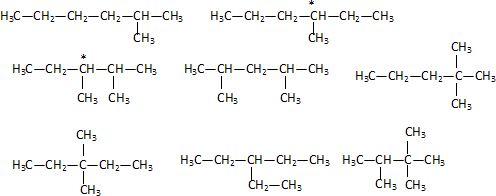
On
considère un hydrocarbure A non cyclique et saturé. A a pour masse
molaire M = 100 g/mol. A appartient a une famille de x isomères de
constitution ; x a pour valeur : 4, 5, 6, 7, 8, aucune valeur exacte.
CnH2n+2 ; M = 12n+2n+2 = 14 n+2 = 100 ; n =7.
CH3- CH2- CH2-CH2- CH2- CH2- CH3.
Question 2.
Lorsqu'on mélange du 2-bromopropane avec des ions hydroxyde, il se
forme majoritairement un composé organique A de formule brute C3H8O. Pour identifier ce composé, des analyses spectrales ont été réalisées.
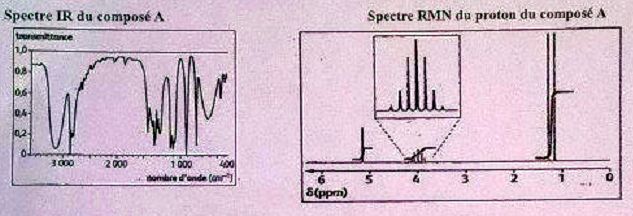
Choisir la ou les affirmation(s) correcte(s).
A. La formule topologique de A est 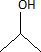 Vrai. Vrai.
Large bande vers 3300 cm-1, alcool associé par liaison hydrogène.
B. La formule topologique de A est : 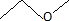 Faux. Faux.
C. La formule semi-développée de A est : CH3-CH2-CH2-OH. Faux.
Le spectre RMN d'une telle molécule présente 4 groupes de protons.
D. Il se forme également de l'eau au cours de la réaction. Faux.
CH3-CHBr-CH3 + HO- ---> CH3-CHOH-CH3 + Cl-.
E. Il s'agit d'une réaction d'élimination. Faux, substitution.
F. Aucune des 5 affirmations n'est exacte.
Question 3.
On considère une solution aqueuse d'un acide faible AH de concentration CA. Le pKa du couple AH / A- vaut 1,5. On réalise le dosage d'un volume VA =10 mL de cet acide par une solution B de soude de concentration CB =0,10 molL. Le volume de soude versé à l'équivalence est VE = 1,0 mL
Choisir la ou les affirmation(s) correcte(s).
A. A l'équivalence de ce dosage le pH est supérieur à 7. Vrai.
La solution contient majoritairement la base faible A-.
B. A l'équivalence de ce dosage le pH est inférieur à 7. Faux.
C. CA = 1,0 10-3 mol/L. Faux.
CA = CB VE / VA = 0,10 *1,0 / 10 = 0,010 mol/L.
D. CA = 1,0 10-1 mol/L. Faux.
E. Le pH de la demi-équivalence est égal à pKa = 1,5. Vrai.
F. Aucune des 5 affirmations n'est exacte.
Question 4.
On donne les formules des principes actifs de trois médicaments.
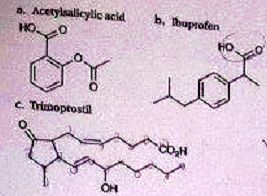
Choisir la ou les affirmation(s) correcte(s).
A. Une seule molécule parmi les trois possède le groupe carboxyle. Faux.
B. Les trois groupes OH visibles sur les molécules présentées correspondent à des fonctions alcools. Faux.
OH du groupe alcool et du groupe carboxyle.
C. Les trois molécules possèdent au moins trois doubles liaisons conjuguées. Faux.
D. La formule brute du trimoprostil est C22H33O4. Faux. C21H34O4.
E. La molécule d'acide salicylique présente un groupe carbonyle. Faux.
Groupe carboxyle et groupe ester.
F. Aucune des 5 affirmations n'est exacte. Vrai.
|
|
|
Question 5.
Le sel de Mohr est un solide de formule FeSO4, (NH4)2SO4, 6H2O.
On dissout du sel de Mohr dans un volume V = 500 mL d'eau afin
d'obtenir une solution dont la concentration en sel de Mohr est c =
2,00 10-2 mol/L.
A. Le sel de Mohr est un solide moléculaire neutre. Faux, solide cristallin.
B. Pour préparer la solution il faut peser m = 15,6 g de sel de Mohr. Faux.
M( sel de Mohr) = 55,8 +2*32,1+14*16+2*14+20=392 g/mol.
n = cV = 0,0200 *0,500 = 0,0100 mol ; m = 392*0,0100 =3,92 g.
C. Pour préparer la solution il faut peser m = 3,95 g de sel de Mohr. Faux.
D.
Le précipité d'hydroxyde de fer obtenu par ajout de quelques
gouttes d'une solution d'hydroxyde de sodium à un prélèvement de
la solution a pour formule Fe(OH)2 (s). Vrai.
D. Dans la solution, la relation entre les concentrations molaires des ions NH4+ et SO42- vérifie [NH4+]=[SO42-]=0,5 c. Faux. [NH4+]=[SO42-]=2 c.
F. Aucune des 5 affirmations n'est exacte. Faux.
Question 6.
L'énergie thermique fournie par un bec Bunsen, alimenté en propane, est
réglée à 4000 kJ /h. L'énergie transférée au cours de la combustion
complète d'une mole de propane est en valeur absolue Qr = 2,00 103 kJ /mol. On donne Vm
= 25 L/mol; L'air est constitué de 20% de dioxygène en volume. Le débit
volumique de l'air admis par la virole ( entrée d'air) du bec Bunsen
est ( m3 h-1) : 1,39 ; 3,00 ; 1,25 ( vrai) ; 1,50 ; autre. :
C3H8 +5O2 --> 3CO2 + 4H2O.
n(propane) = 4000 / 2000 = 2 mol / h. ; n(dioxygène) = 10 mol / h ; n(air) =50 mol /h.
Débit : 50*25 =1250 L / h = 1,25 m3 / h.
|
|
|
|
Question 7.
On considère une solution d'hydroxyde de calcium Ca(OH)2 obtenue par dissolution totale du solide ionique Ca(OH)2. Cette solution est telle que la concentration en ion calcium est égale à 5,00 10-3 mol/L. Quel est le pH à 25°C de cette solution ?
10,0 ; 11,0 ; 11,7 ; 12,0 vrai ; 12,4 ; autre.
[HO-] = 2 [Ca2+] = 1,00 10-2 mol/L.
pH = 14 + log ( 1,00 10-2) = 12,0.
C. Dans une formule mathématique, telle que exp(u), ln (u) ou cos (u),
u doit être sans dimension. Vrai.
D. Dans une relation du type x y + z2 = t2, on
peut dire que z et t ont la même dimension. Vrai.
E. Dans une relation
du type x y + z2 = t2, on peut dire que y a la
même dimension que t. Faux.
Question 8.
Lorsqu'on met en présence du 2-bromopropane avec des ions hydroxydes HO-, l'un des produits qui se forme à l'état de traces a comme formule C3H6. Choisir la ou les affirmation(s) correctes.
A. C'est une réaction de substitution. Faux. ( Ellimination).
CH3-CHBrCH3 + HO- --> CH3-CH=CH2 +H2O +Br-.
B. C'est une réaction d'addition. Faux.
C. C'est une réaction par transfert de doublet d'électrons de l'atome d'oxygène de l'ion HO- vers l'atome de brome du 2-bromopropane. Faux.
D. Il se forme également du dibrome et de l'eau au cours de la réaction. Faux.
E. L'une des liaison C-H du 2-dibromopropane est rompue. Vrai.
F. Aucune des affirmations précédentes n'est correcte. Faux.
Exercice 9.
A propos des isomères de constitution du butanol ( appartenant à la même famille que ceui-ci). Choisir la ou les affirmation(s) correctes.
A. L'un des isomères présente un spectre RMN avc uniquement deux signaux : deux singulets. Vrai.
(CH3)3C-OH.
B. L'un des isomères présente un spectre RMN contenant un heptuplet. Faux.
C. Les spectres RMN des isomères présentent tous un doublet. Faux.
D. Deux des isomères sont des alcools secondaires. Faux.
CH3-CH2-CH2-CH2OH et (CH3)2CH-CH2OH ( alcools primaires) ;
CH3-CH2-CHOH-CH3.( alcool secondaire) ; (CH3)3C-OH. ( alcool tertiaire ).
E. On peut les distinguer par spectroscopie IR sans tenir compte de la partie " empreinte du spectre".. Faux.
F. Aucune des affirmations précédentes n'est correcte. Faux.
Exercice 10.
Le propan-2-ol est lentementoxydé par les ions permanganate pour former C3H6O.
A une date t=0, à la température de 30°C, on introduit dans un
erlenmeyer 1,0 mL de propan-2-ol et 50 mL d'une solution de
permanganate de potassium acidifié de concentration c0 =
0,20 mol/L. On suit lévolution temporelle de la transformation en
déterminant périodiquement l'avancement de la réaction. On prélève à
une date t, un volume du mélange réactionnel auquel on ajoute de l'eau
glacée. Par dosage, on détermine la concentration des ions MnO4-
contenus dans le prélèvement, pour déterminer l'avancement x. On
renouvelle l'opération à différentes dates t on obtient la courbe (a)
ci-dessous.
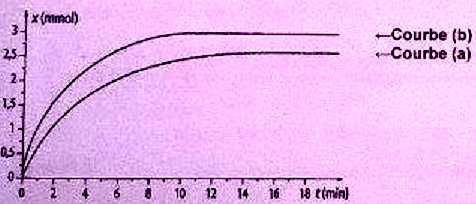
On donne : masse volumique du propan-2-ol : r =0,80 g/L ; M(C3H8O) = 60 g/mol ; couples redox C3H6O / C3H8O ; MnO4- / Mn2+ ; seul MnO4- est coloré ( violet). Choisir la ou les affirmation(s) correctes.
A. L'ion permanganate a été introduit en défaut. Faux.
5C3H8O + 2MnO4- +6H+ -->2 Mn2+ +5C3H6O +8H2O.
n(C3H8O) =0,80 / 60=0,0133 mol ; n(MnO4-) =0,050*0,20 =0,01 mol.
0,0133 mol d'alcool réagit avec 0,0133 / 2,5 =0,0053 mol d'ion permanganate.
B. Cette réaction peut être suivie par spectroscopie en réglant le spectrophotomètre sur une longueur d'onde de 420 nm. Faux.
La
solution étant violette elle présente un maximum d'absorption dans le
rouge. Il faut choisir une longueur d'onde correspondant à ce maximum.
C. L'ajout d'eau glacée a pour seul but de diluer le mélange. Faux, blocage cinétique.
D. A 30°C, le temps de demi-réaction est de 7 minutes. Faux ( ~ 2 minutes).
E. La courbe (b) a été obtenue après ajout d'un catalyseur dans le milieu réactionnel. Faux.
Un catalyseur accélère la réaction sans modifier la composition finale.
F. Aucune des affirmations précédentes n'est correcte. Vrai.
|
|