QCM
chimie.
Concours kiné St Michel 2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
Exercice 1.
Un acide aminé a pour formule générale :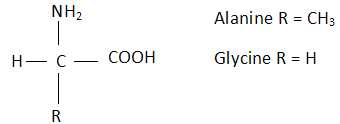
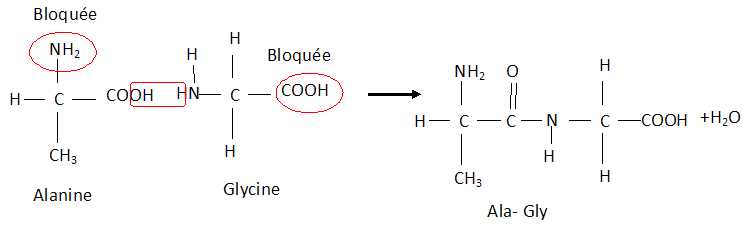
Une liaison peptidique entre deux acides aminés se forme par
élimination d'une molécule d'eau au cours de la réaction entre le
groupe -COOH d'un acide aminé et le groupe -NH2 d'un
autre acide aminé. Un dipeptide est nommé par les abréviiations à trois
lettres des acides aminés à partir desquels ils sont construits. Pour
construire le nom du dipeptide, on commence par l'acide aminé qui
a gardé sont groupenent -NH2 libre.
A.
La glycine et l'alanine sont des molécules chirales. Faux.
Seule l'alanine est chirale, elle possède un atome de carbone asymétrique.
B. Une liaison peptidique est une liaison amide. Vrai.
C. La réaction entre la glycine (Gly) et l'alanine (Ala) conduit à la formation de deux dipeptides Ala-Gly et Gly-Ala. Faux.
Quatre dipeptides peuvent être formés : Ala-Ala ; Gly-Gly ; Ala-Gly et Gly-Ala.
D. Pour obtenir uniquement le
dipeptide Ala-Gly lors de la réaction entre la glycine et l'alanine,il
faut bloquer la fonction amine de la glycine et la fonction acide
carboxilique de l'alanine. Faux.
Exercice 2. Spectre RMN.
Le spectre RMN d'une molécule de formule brute C3H5ClO est représenté ci-dessous.
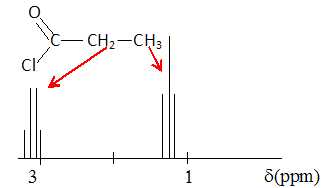
A. Le signal à 1,24 ppm est un triplet. Vrai.
B. Le signal à 2,93 ppm correspond à un groupe de 4 ptotons équivalents. Faux.
C. Les protons du signal situés à 2,93 ppm sont voisins de trois protons. Vrai.D. La formule semi-développée de la molécule étudiée est CH3-CH2-COCl.
Vrai.
Exercice 3. Isomérie.
A. Un alcool primaire et un alcool secondaire peuvent être isomères.
Vrai.B. Le 2-méthylpropanal et la butan-2-one sont isomères
.
Vrai.
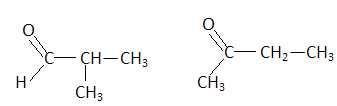
C. La molécule représentée ci-dessous possède deux stéréoisomères appelés énantiomères.
Vrai.
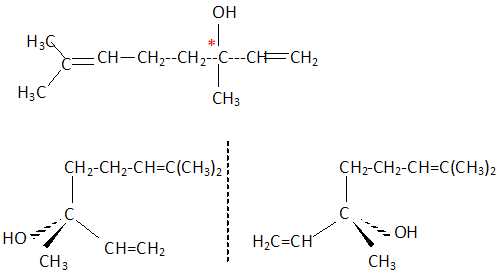
D. Le pent-2-ène donne lieu a une isomérie Z / E. Faux. 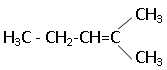
Exercice
4 et 5. Eau oxygénée.
On
considère la transformation lente de décomposition de l'eau oxygénée
par les ions iodure en présence d'acide sulfurique, transformation
considérée comme totale.
H2O2(l) +2I-aq +2H3O+aq = I2aq +4H2O(l).
La
solution de diiode formée est colorée. A la date t=0 on mélange
20,0 mL d'une solution d'iodure de potassium de concentration c1 = 0,10 mol/L acidifiée avec de l'acide sulfurique en excès, 8,0 mL d'eau et 2,0 mL d'eau oxygénée à 0,10 mol/L.
La courbe ci-dessous représente les variations de l'avancement x de la transformation en fonction du temps.
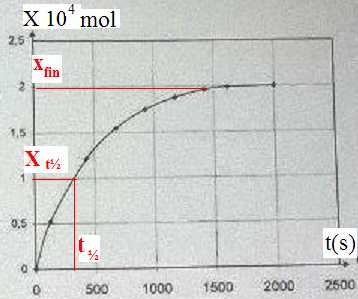
A. Cette transformation peut être suivie par spectrophotométrie. Vrai.
B.
Le mélange initial est stoechiométrique. Faux.
n(I- ) =20,0*0,10 = 2,0 mmol ; n(H2O2) =2,0*0,10 =0,20 mmol.
0,20 mmol d'eau oxygénée réagit avec 0,40 mmol d'ion iodure.
C. Les couples oxydant / réducteur mis en jeu sont I2aq / I-aq et H3O+aq / H2O(l). Faux.
I2aq / I-aq et H2O2aq / H2O(l).
D. La concentration du diiode en fin de réaction est égale à : 2c1 / 30. Vrai.
n(I2) = n(H2O2) = 0,20 mmol dans 30 mL de solution.
[I2]=0,20 / 30 = 2c1 / 30 mol/L.
A. Le temps de demi-réaction est de 1000 s. Faux.
B. Si on double la concentration d'eau oxygénée à l'état initial, l'avancement maximal double. Vrai.C. La vitesse de la réaction augmente au cours du temps. Faux.
La pente de la tangente à la courbe est maximale à t =0, puis diminue jusqu' à s'annuler ( tangente horizontale).
D. Le pH du milieu réactionnel augmente au cours du temps. Faux.
|
|
|
Exercice 6. Alcools.
On considère les alcools suivants : (a) pentan-1-ol ; (b) pentan-2-ol ; (c) 2-méthylbutan-1-ol ;
(d) 2,2-diméthylpropan-1-ol.
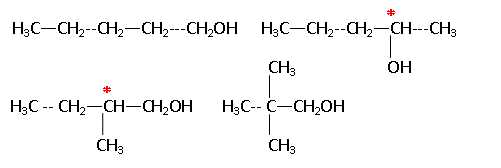
A. Ces molécules sont isomères de position. Faux.
B. La molécule (d) est un alcool secondaire. Faux, alcool tertiaire.
C. Par oxydation la molécule (c) conduit au 2-méthylbutanal puis à l'acide 2-méthylpropanoïque. Faux.
....... puis à l'acide 2-méthylbutanoïque.
D. Le classement des températures d'ébullition des alcools ci-dessus est (d) < (c) < (b) < (a). Vrai.
Les températures d'ébullition des alcools non ramifiés augmentent avec la longueur de la chaine carbonée.
Pour un même nombre de carbone, la température d'ébullition diminue pour un alcool ramifié.
Exercice 7.
Evolution d'un système chimique.
On mélange une solution d'acide oxalique de formule brute H2C2O4 de concentration c1 = 3,0 10-2 mol/L et de volume V1 = 100,0 mL avec une solution de dichromate de potassium ( 2K+aq +Cr2O72-aq) de concentration c2 = 1,0 10-2 mol/L et de volume V2 = 100,0 mL.
Couples redox mis en jeu : Cr2O72- / Cr3+et CO2 / H2C2O4.
A.
La réaction doit avoir lieu en milieu acide. Vrai.
3 fois { H2C2O4 = 2CO2 +2H++2e- }.
Cr2O72- +14H+ +6e-= 2 Cr3++7H2O.
Cr2O72- +8H+ +3H2C2O4 = 2 Cr3++7H2O +6CO2.
B. Pour l'acide oxalique, la demi-équation s'écrit : 2CO2 +2H+ =H2C2O4. Faux.
C.
L'acide oxalique est le réactif limitant. Vrai.
n(H2C2O4) = c1V1 = 3,0 mmol ; n(Cr2O72-) =c2V2 = 3,0 mmol.
3,0 mmol d'acide oxalique réagissent avec 1,0 mmol .d'ion dichromate ;
il se forme 2,0 mmol d'ion chrome (III).
D.
La concentration finale des ions chrome (III) est 1,0 10-2 mol/L. Vrai.
n(Cr3+) =2,0 mmol dans 200,0 mL.
2,0 / 200 = 0,010 mol/L.
|
|
|
|
Exercice 8. La soude.
On prépare une solution de soude en dissolvant 0,8 g de soude dans 100 mL d'eau. M(NaOH) = 40 g/mol ; log 2 = 0,3.
A.
La concentration de la solution est égale à 0,05 mol/L. Faux.
n(soude) = 0,8 / 40 =0,020 mol ; (NaOH]=0,020 / 0,100 = 0,2 mol/L.
B. Le pH de la solution est 13,3. Vrai.
pH = 14 + log c = 14 + log 0,2 = 14 + log (2 / 10) =14 +0,3 -1 = 13,3.
C. Si on ajoute 100 mL d'eau, le pH diminue de 1. Faux.
Nouvelle concentration : c' = 0,2 / 0,200 = 0,10 mo/L ; pH =14 + log 0,1=13.
D. La soude est une base faaible carson pH est inférieur à 14. Faux.
Exercice 9.
Pile.
On
dispose d'une lame de plomb et d'une lame de cuivre qui ont une
massede 100 g chacune. La lame de plomb est plongée dans une solution
aqueuse de sulfate de plomb ( Pb2+aq + SO42-aq). La lame de cuivre est plongée dans une solution aqueuse de sulfate de cuivre ( Cu2+aq + SO42-aq).
Les deux solutions ont un volume de 100 mL et une concentration de 0,5
mol/L. Les deux demi-piles sont reliées par un pont salin contenant une
solution aqueuse très concentrée de nitrate de potassium ( K+aq +NO3-aq).
Le courant circule de l'électrode de cuvre vers l'électrode de plomb
dans le circuit extérieur. Les couples intervenant dans cette pile sont
: Cu2+aq/ Cu(s) et Pb2+aq / Pb(s).
A.
La lame de cuivre constitue la borne positive de cette pile. Vrai.
B. Le plomb est oxydé. Vrai.
A l'anode négative, le plomb est oxydé en ion Pb2+aq . Pb(s)=Pb2+aq + 2e- .
C. La lame de cuivre constitue le réactif limitant. Faux.
A la cathode positive, les ions Cu2+aq sont réduits en cuivre solide. Cu2+aq + 2e- = Cu(s).
D. L'équation de fnctionnement de la pile est : Cu(s) + Pb2+aq --> Cu2+aq + Pb(s). Faux.
Pb(s)+Cu2+aq =Pb2+aq +Cu(s).
Exercice 10 et 11. Estérification.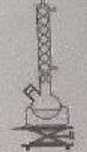
Cet exercice contient une erreur, la masse molaire de l'alcool n'est pas 74 g /mol,mais 60 g/mol et le volume d'alcool est 60 mL.
La réaction entre un acide carboxylique R-COOH et un alcool R1-OH est une transformation chimique qui conduit à la formation d'un ester de formule R-COO-R1
et d'une molécule d'eau. L'oxygène marqué de l'alcool est celui qui se
retrouve généralement dans l'ester. On s'intéresse à la réaction qui
conduit à l'ester H3C-CH2-CH2-O CO CH3.
Protocole
: placer deux flacons, l'un contenant l'acide et l'autre l'alcool dans
un bain d'eau froide. Préparer le montage ci-desus en mélangeant 60 mL
d'acide et 60 mL d'alcool ainsi que quelques grains de pierre ponce
dans le ballon bicol. Placer le ballon dans un bain d'eau froide.
Ajouter quelques gouttes d'acide sulfurique et insérer le ballon dans
le montage. Fixer la température à 20°C.
Alcool : M= 60 g/mol ; densité d = 0,81 ; acide M = 60 g/mol ; d= 1,05 ; ester M = 102 g/mol ; d = 0,89.
A. La réaction d'estérification est une réaction de substitution. Vrai.
B.
L'ester obtenu est le propanoate d'éthyle. Faux, éthanoate de propyle.
C. Le montage utilisé est un montage à reflux. Vrai.
D. Les grains de pierre ponce permettent d'accélerer la réaction d'estérification, très lente. Faux.
A. En considérant la raction totale on obtiendrait 82,6 g d'ester. Faux.
n(acide) = 60*1,05 / 60 = 1,05 mol ; n(alcool) = 60*0,89 / 60 = 0,89 mol ; n(ester )= 0,89 mol soit 0,89*102 ~91 g.
B.
L'ajout d'acide sulfurique accélère la réaction et permet d'obtenir un meilleur rendement. Faux..
L'ajout d'acide sulfurique accélère la réaction sans changer le rendement.
C. La flèche courbe représente ce qui pourrait être la première étape de la réaction entre l'acide et l'alcool. Faux.
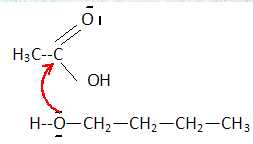
La flèche représente la première étape mais ce n'est pas la bonne formule de l'alcool.
D. L'atome d'oxygène étant un élément très électronégatif, il est bon site accepteur d'électrons. Faux.
Un bon site accepteur d'électrons est déficitaire en électrons.
|
Exercice 12. L'acide ascorbique.
Un comprimé de vitamine C contient de l'acide ascorbique de formule brute C6H8O6 et de l'ascorbate de sodium. L'acide ascorbique sera noté HA et sa base conjuguée, l'ion ascorbate A-.
Ka(AH/A-) = 10-4,1 à 37°C M( acide ascorbique ) = 176,1 g/mol..
pH de lestomac ~1,5 ; pH de la salive : 5,5 à 6,1.
Conductivités molaies ionique en mS m2 mol-1 : l HO- = 19,9 ; lNa+ = 5,01 ; l A- =3,42.
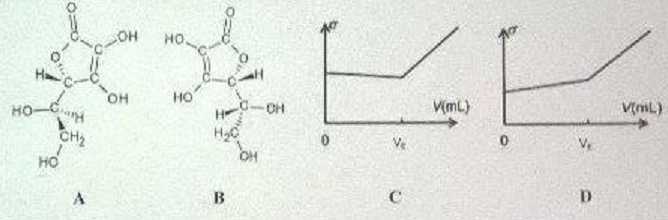
A.
L'acide ascorbique est à la fois un alcool et un acide carboxylique. Faux.
On compte deux fonctions alcool et un groupe ester cyclique.
B. A et B sont diastéréoisomères. Vrai.
Un seul des deux atomes de carbone asymétriques a changé de configuration.
C.
Le pH de la salive est acide. Lorsque l'on fait fondre un
comprimé de vitamine C dans la bouche, c'est donc l'acide ascorbique
qui prédomine. Faux.
La forme HA prédomine à pH inférieur à pKa, soit 4,1.
D. L'évolution de la conductivité s lors du titrage conductimétrique de l'acide ascorbique C par la soude correspond à la représentation C. Faux.
Avant l'équivalence,( ion HO- en
défaut ) du point de vue de la conductivité, on ajoute des ions
sodium et il se forme des ions ascorbate : la conductivité croît
lentement.
Après l'équivalence, on ajoute des ions sodium et hydroxydeen excès (l HO- >l A- ) et des ions sodium: la conductivité croît plus rapidement.
Exercice 13. Molécules colorées.
Les formes acide et basique d'un composé de formule brute C20H14O4 sont données.
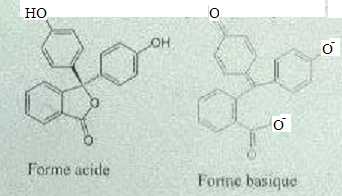
A. Ce composé est un composé organique. Vrai.
B.
La forme acide compte 10 liaisons doubles. Vrai.
C.
Seule la forme basique est colorée. Vrai.
Seule la forme basique possède un grand nombre de liaisons doubles conjuguées.
F. Ce composé est un indicateur coloré. Vrai.
|
|