Arôme de menthe,
bac
S Polynésie 2017 .
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
|
|
|
|
|
|
Les
molécules comme celle du menthol créent la sensation de froid en
activant des mécanismes sensoriels, sans qu'il y ait pour autant des
échanges thermiques.
1. Menthol et menthone.
l'arôme naturel de menthe est principalement dû à trois molécules : le
(-)menthol, la menthone et l'éthanoate de menthyle. L' (-) menthol
s'incère dans les cellules olfactives comme une clef dans une serrure,
en donnant un note fraîche et mentholée. Son stéréoisomèree, le (+)
menthol donne une sensation de moisi.
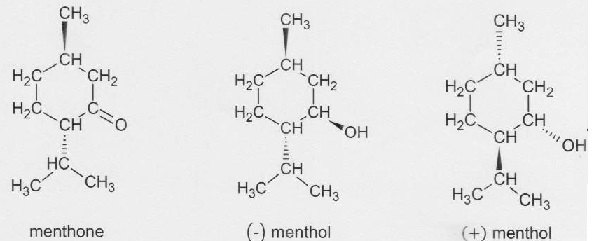
1.1. Donner la
représentation topologique des molécules de menthone et de (-) menthol.
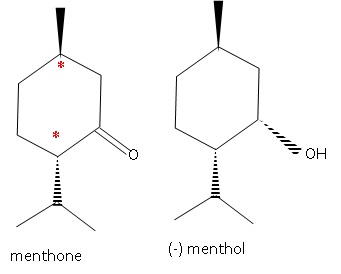
1.2 Repérer le(s)
atome(s) de carbone asymétrique sur la représentation topologique de la
menthone. Justifier.
Un atome de carbone asymétrique est un atome de carbone tétragonal lié
à 4 atomes ou groupes d'atomes différents. Ils sont repérés par *.
1.3. Donner le nom
du type de stéréoisomérie de configuration qui lie les deux molécules
de (-) menthol et de (+) menthol.
Le (-) menthol et de (+)
menthol sont deux énantiomères, image l'un de l'autre dans un miroir
plan.
|
....
.....
|
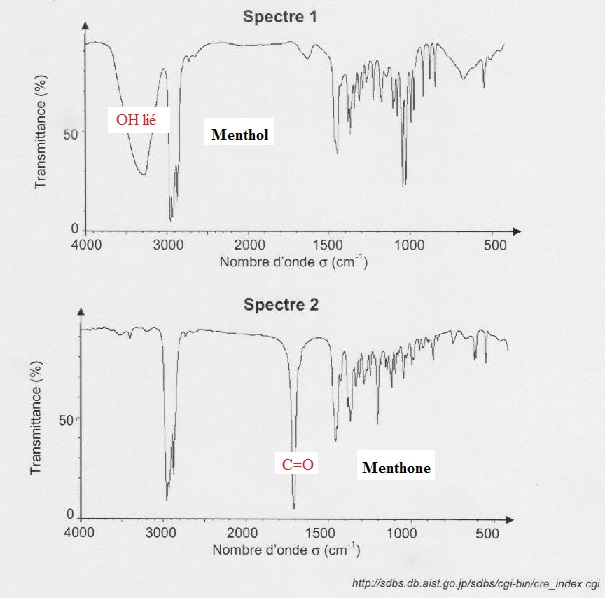
1.4
. Le spectre IR de la menthone et celui du menthol sont donnés
ci-dessous. Choisir en justifiant celui correspondant à la menthone.
2. Synthèse de l'éthanoate
de menthyle.
Cet ester peut être préparé à partir d'acide éthanoïque et de menthol.
menthol C10H20O + acide éthanoïque C2H4O2
= éthanoate de menthyle C12H22O2
+eau. Le Protocole de cette synthèse est décrit ci-dessous :
- Verser dans un ballon 15,6 g de menthol puis, avec précaution, 11,0
mL d'acide éthanoïque pur et enfin quelques gouttes d'acide sulfurique
concentré.
- Chauffer à reflux le mélange réactionnel pendant 40 minutes.
- Verser le mélange obtenu dans un bécher contenant 100 mL de solution
aqueuse de chlorure de sodium.
- Extraire la phase organique contenant l'éthanoate de menthyle à
l'aide d'une ampoule à décanter.
- Laver la phase organique avec une solution saturée
d'hydrogénocarbonate de sodium (Na+aq +HCO3-aq).
On observe une effervescence.
- Agiter quelques instants en dégazant régulièrement, puis éliminer la
phase aqueuse.
- Sécher la phase organique avec du sulfate de sodium anhydre.
Au laboratoire, en suivant ce protocole, on a obtenu m = 12 g
d'éthanoate de menthyle.
2.1. Les synthèse
peuvent conduire à la modification des chaines et/ou des groupes
caractéristiques. Identifier le type de modification associée à cette
synthèse.
Estérification d'un alcool par l'acide éthanoïque. On obtient un ester
: donc, le groupe caractéristique est modifié. Par contre, la chaine du
menthol n'est pas modifiée.
2.2. Etude du protocole.
2.1.1 l'acide
sulfurique est un catalyseur. Préciser son action dans la synthèse.
Le catalyseur permet d'atteindre plus rapidement l'état d'équilibre
sans modifier la composition de ce dernier. Le catalyseur est régénéré
au cours de la dernière étape de la synthèse.
2.2.2. Représenter
le montage nécessaire à la synthèse. Le nommer et expliquer son intérêt.
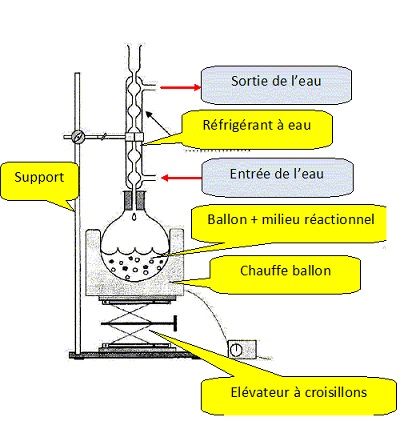
La température est un facteur cinétique. Les vapeurs se
condensent dans le réfrigérant et retombent dans le milieu
réactionnel. La réaction est accélérée et on évite les pertes de
matière.
|
|
|
2.2.3.
Justifier l'utilisation d'une ampoule à décanter
pour éliminer la phase aqueuse lors de la dernière étape.
L'éthanoate de menthyle ( phase organique ) est très peu miscible à
l'eau. L'éthanoate de menthyle est moins dense que l'eau ( d = 0,92).
Il occupe donc la partie supérieure de l'ampoule à décanter.
2.2.4 Lors du
lavage de la phase organique, l'acide éthanoïque réagit avec les ions
hydrogénocarbonate. Ecrire l'équation de cette réaction
acido-basique et justifier les observations expérimentales faites.
HCO3-aq + CH3COOH aq ---> CH3COO-aq
+ CO2(g) + H2O(l).
On observe un dégagement gazeux de dioxyde de carbone.
2.3. Rendement de la
synthèse.
2.3.1. Identifier
le réactif introduit en excès.
Quantité de matière initiale :
menthol : m / M(menthol) = 15,6 / 156 = 0,10 mol.
acide éthanoïque : masse = volume x masse volumique = 11,0 x1,05
= 11,55 g.
11,55 / M(acide éthanoïque) = 11,55 / 60 ~0,19 mol.
0,1 mol de menthol réagit avec 0,10 mol d'acide éthanoIque pour
conduire à 0,10 mol d'ester ( si la réaction est totale).
L'acide éthanoïque est en excès.
2.3.2. Déterminer
le rendement de cette synthèse.
Masse théorique d'ester : 0,10 x M(ester) = 0,10 x198 = 19,8 g
rendement = masse expérimentale / masse théorique = 12 /19,8 =0,606 ( ~61 %).
2.3.3. proposer une
explication permettant de justifier un rendement inférieur à 100 %.
La réaction n'est pas totale : l'ester formé réagit partiellement avec
l'eau pour conduire au menthol et à l'acide éthanoïque.
3. Menthe glaciale.
Le sirop de menthe glaciale est de couleur bleu-vert ( cyan). Sur
l'étiquette d'une bouteille de ce sirop on lit : Sucre, sirop de
glucose fructose, eau, arôme de menthe, colorant E133.
Pour déterminer la concentration en colorant E133 du sirop de menthe :
- on dilue 5 fois le sirop de menthe glaciale ; la solution est notée S.
- on réalise une échelle de teinte composée de 4 solutions de colorant
E133 de concentrations différentes.
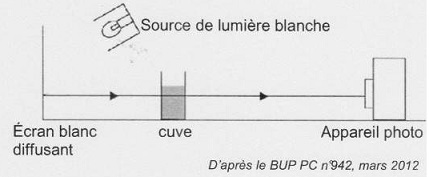
On dispose devant un écran éclairé par une source de lumière blanche,
une série de 6 cuves contenant :
- les 4 solutions de l'échelle de teinte, notées S1, S2,
S3 et S4.
- de l'eau distilée (" blanc") notée S0.
- la solution diluée de sirop de menthe S.
L'ensemble est photographié avec un appareil photographique numérique.
|
|
|
|
Les
hypothèses de travil sont : cuves identiques et éclairage
uniforme des cuves ; le colorant E133 est la seule espèce colorée dans
ce sirop.
Le cliché en couleur, reproduit en noir et blanc ci-après, est analysé
à l'aide d'un utilitaire permettant de connaître les codes couleurs des
pixels.
En codage RVB 24 bits, la réponse pour la composante rouge R, la
composante verte V et la composante bleue B est traduite par un nombre
compris entre 0 et 255 correspondant aux différentes nuances
d'intensité lumineuse d'une même couleur.
L'absorbance associée à la composante R ou V ou B est déterminée par :
A = log( valeur du code de la composante considérée dans le blanc /
valeur du code de la même composante dans la solution colorée).
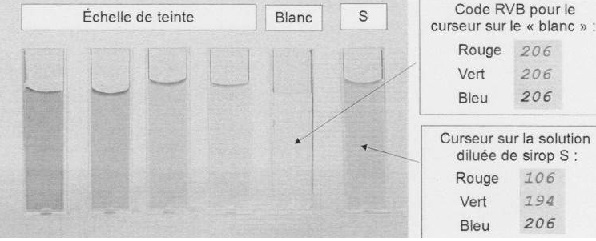
Les résultats obtenus sont les suivants :
|
Echelle
de teinte
|
"Blanc"
|
Solutions
|
S1
|
S2
|
S3
|
S4
|
S0
|
Concentration
( mg / L)
|
24,0
|
12,0
|
6,0
|
3,0
|
0
|
Valeur
du code correspondant à la composante R
|
30
|
80
|
128
|
163
|
206
|
| Valeur
du code correspondant à la composante V |
180
|
191
|
198
|
201
|
206
|
| Valeur
du code correspondant à la composante B |
204
|
204
|
206
|
205
|
206
|
Quelle est la composante RVB la plus absorbée par une solution de sirop
de menthe ? Ce résultat était-il prévisible ?
La composante rouge est la plus absorbée : la valeur du code
correspondant à la composante R est très inférieure aux composante B et
V.
Cela était prévisible, le rouge est la couleur complémentaire du cyan,
couleur du sirop de menthe.
3.2. Déterminer la
concentration massique du sirop de menthe glacial..
On travaille avec la composante R, la plus absorbée.
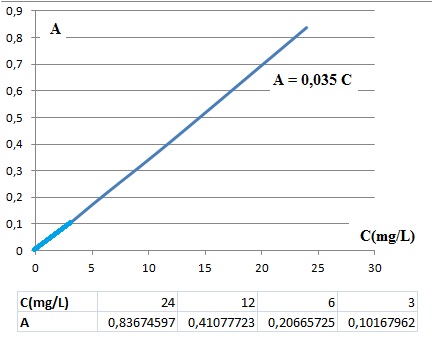
Absorbance de S : A =log(206 /106)=0,288.
Concentration de S en colorant E133 : 0,288 / 0,035 ~8,2 mg /L.
Tenir compte de la dilution : 5 x 8,2 ~41
mg/L.
..
|
|