Du fromage et du
beurre, méthanisation,
bac
S Métropole 09 /2017 .
|
|
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
|
|
|
|
|
|
L’acide butanoïque est l’un des
composés responsables de l’odeur très forte et du goût piquant de
certains fromages et beurres rances.
Cet
exercice se propose d’étudier quelques propriétés de l’acide
butanoïque, sa formation dans les fromages et son titrage dans le
beurre.
Données :
L’acide butanoïque C 4H 8O 2 est un
acide faible ; le pK a du couple acide / base auquel il
appartient vaut 4,8 à 25 °C.
Masse molaire de l’acide lactique : M 1 = 90,0 g.mol -1.
Masse molaire de l’acide butanoïque : M 2 = 88,0 g.mol -1.
1. Quelques propriétés de l’acide butanoïque.
1.1. Représenter la
formule topologique de l’acide butanoïque.
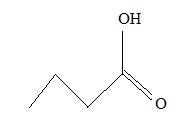
1.2. Écrire
l’équation de la réaction entre l’acide butanoïque et l’eau.
C3H7-CO2H aq +H2O (l) =C3H7-CO2-
aq +H3O+ aq.
1.3. À 25 °C, le pH d’une solution
aqueuse d’acide butanoïque de concentration 3,0 × 10-2 mol.L-1
vaut 3,2. Cette valeur de pH est-elle en accord avec le caractère «
acide faible » attribué à l’acide butanoïque ?
Dans l'e cas d'un acide fort, pH= -log C = -log(3,0 10-2)
~1,5.
Le pH mesuré est égal à 3,2, valeur supérieure à 1,5 : l'acide
butanoïque est donc un acide faible.
2. La fermentation
butyrique dans le fromage
Dans les fromages, l’acide butanoïque est produit
par fermentation de l’acide lactique du lait en présence de la bactérie
Clostridium tyrobutyricum.
Cette fermentation, dite butyrique, est modélisée par la réaction
totale d’équation :
2 C3H6O3 (aq) --> C4H8O2
(aq) + 2 CO2 (g) + 2 H2 (g)
Les premiers signes de fermentation butyrique sont généralement
visibles après 6 à 10 semaines d’affinage. Cela se manifeste par un
goût rance et, très souvent par un gonflement, voire un éclatement des
fromages. Le phénomène peut conduire à la destruction de toute une
production.
D’après www.agroscope.com
2.1. Justifier le
gonflement des fromages lors de la fermentation butyrique.
La fermentation donne naissance à deux gaz, le dioxyde de carbone et le
dihydrogène.
2.2.
Le site www.agroscope.com indique par ailleurs que la fermentation de
2,0 g d’acide lactique conduit à la formation d’environ 1 g d’acide
butanoïque. Vérifier que cette information est correcte.
Quantité de matière d'acide lactique : 2,0 / 90,0 ~ 0,0222 mol.
Quantité de matière d'acide butyrique : 0,0222 / 2 ~0,0111 mol.
Masse d'acide butyrique : 0,0111 x 88 ~0,97 g.
|
....
.....
|
3. Analyse d’un beurre.
Un beurre est rance si le pourcentage en masse d’acide butanoïque qu’il
contient est supérieur ou égal à 4 %, c’est-à-dire qu’il y a plus de 4
g d’acide butanoïque dans 100 g de beurre.
On peut titrer l’acide butanoïque contenu dans un beurre de la façon
suivante. Dans un bécher, on introduit 8,0 g de beurre fondu auquel on
ajoute un grand volume d’eau distillée. On agite afin de dissoudre dans
l’eau la totalité de l’acide butanoïque présent dans le beurre.
Dans le bécher, on plonge la sonde d’un conductimètre, puis on verse,
mL par mL, une solution d’hydroxyde de sodium (Na+(aq) + HO-(aq))
de concentration C = 4,0 × 10-1 mol.L-1. Après
chaque ajout de solution titrante, on mesure la conductivité σ de la
solution dans le bécher.
On considère que seul l’acide butanoïque réagit avec le réactif titrant.
L’équation de la réaction support du titrage est la suivante :
C4H8O2 (aq) + HO- (aq) → H2O
(ℓ) + C4H7O2 - (aq)
La courbe représentant les variations de la conductivité σ en fonction
du volume Vb de solution d’hydroxyde de sodium versé est
représentée.
3.1. Déterminer la
valeur de la quantité de matière d’ions hydroxyde versée à
l’équivalence.
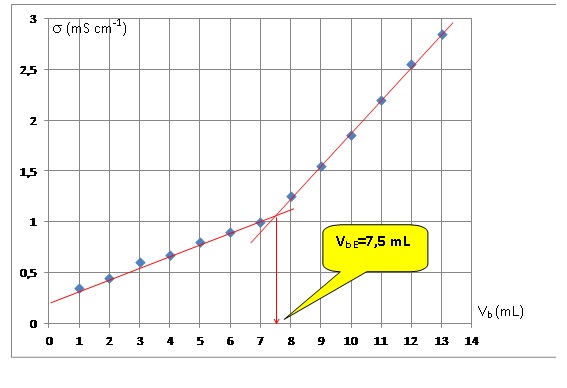
Quantité de matière d’ions
hydroxyde versée à l’équivalence :
7,5 10-3 x4,0 10-1 = 3,0 10-3 mol.
3.2. Le beurre analysé est-il rance ?
Quantité
de matière correspondante d'acide butanoïque : 3,0 10-3 mol.
Masse d'acide butanoïque : 3,0 10-3 x88,0 = 0,264 g dans 8 g
de beurre, soit :
0,264 / 8 ~0,033 ( 3,3 %).
Cette valeur est inférieure à 4 %, le beurre n'est pas rance.
La méthanisation.
La méthanisation est un processus naturel de dégradation biologique de
la matière organique dans un milieu anaérobie (sans dioxygène) sous
l’action de différentes bactéries. Elle présente le double avantage de
traiter les déchets organiques comme, par exemple, la cellulose
d’origine agricole tout en produisant du « biogaz ». La méthanisation
se déroule en quatre étapes dans une unité industrielle appelée «
digesteur ». Ces quatre étapes sont : l’hydrolyse, l’acidogénèse,
l’acétogénèse et la méthanogénèse.
Dans cet exercice, on se propose d’étudier les deux premières étapes de
méthanisation de la cellulose, puis d’estimer les besoins énergétiques
couverts par une usine de méthanisation.
1. Hydrolyse de la
cellulose.
La cellulose est hydrolysée en glucose grâce à l’action de bactéries.
On considère que la totalité de la cellulose contenue dans le digesteur
finira par être consommée.
1.1. Compléter les
deux étapes du mécanisme d’hydrolyse de la cellulose en glucose avec
des flèches courbes qui permettent d’expliquer les formations ou les
ruptures de liaisons.
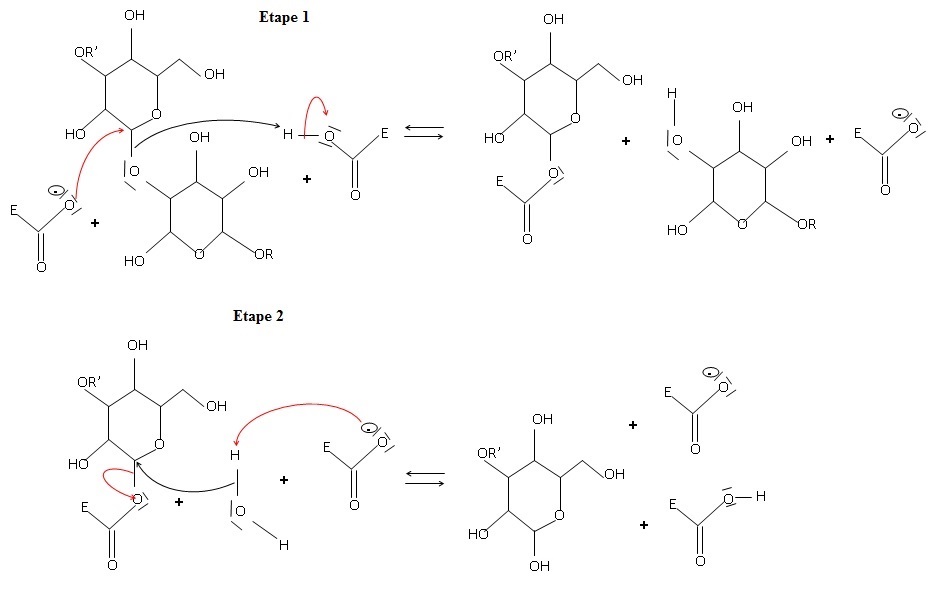
|
|
|
On étudie la cinétique de la
réaction d’hydrolyse de la cellulose. Le
graphique suivant donne l’évolution de la concentration massique en
cellulose dans le digesteur en fonction
du temps.
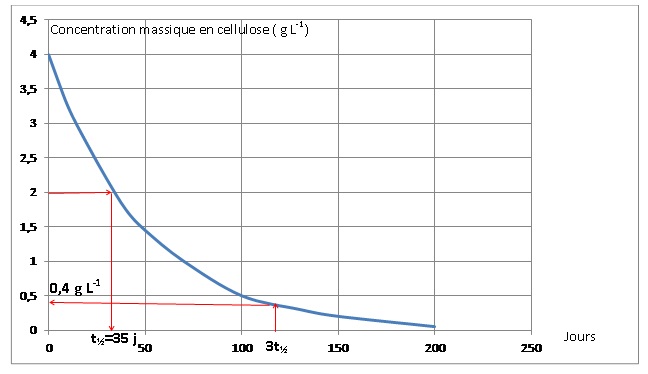
1.2. Déterminer, en
justifiant, le temps de demi-réaction t1/2 de la réaction
d’hydrolyse de la cellulose.
La transformation étant totale, la concentration en cellulose à t½
est égale à la moitié de la concentration initiale.
1.3. En déduire le
pourcentage massique de cellulose restant dans le digesteur au bout
d’une durée égale à 3 t1/2. Commenter.
0,4 / 4 = 0,1 ( 10 %).
Au bout de 115 jours, 90 % de la cellulose est hydrolysée.
|
|
|
|
L’acidogenèse
est la seconde étape du processus de conversion de la matière
organique. Elle transforme les produits de l’étape d’hydrolyse en
acides carboxyliques, en dioxyde de carbone et en dihydrogène.
Lors de cette étape, la dégradation du glucose (C6H12O6),
peut se faire selon différentes voies dont :
Réaction n°1 : 3 C6H12O6 (aq) → 2 CH3CO2H
(aq) + 4 CH3CH2CO2H (aq) + 2 CO2
(g) + 2 H2O (ℓ)
Réaction n°2 : C6H12O6 (aq) → CH3CH2CH2CO2H
(aq) + 2 CO2 (g) + 2 H2 (g)
On donne le spectre RMN d’un des acides carboxyliques obtenus lors des
réactions 1 ou 2 précédentes :
1.4. Écrire la
formule semi-développée de l’acide propanoïque.
1.5. Montrer que,
parmi les trois acides carboxyliques formés lors des réactions 1 et 2,
seul l’acide propanoïque est compatible avec le spectre RMN proposé.
Attribuer chacun des signaux du spectre RMN de la figure 2 aux
différents groupes de protons équivalents de la molécule d’acide
propanoïque.
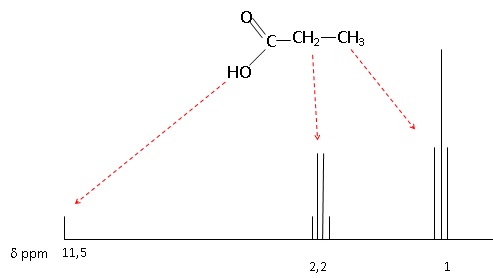
L'acide propanoïque compte trois groupes de protons, tandis que l'acide
éthanoïque en compte deux et l'acide butanoïque trois.
Le groupe CH3 est lié à un carbone comptant deux protons :
son signal est un triplet.
Le groupe CH2 est lié à un carbone comptant trois protons :
son signal est un quadruplet.
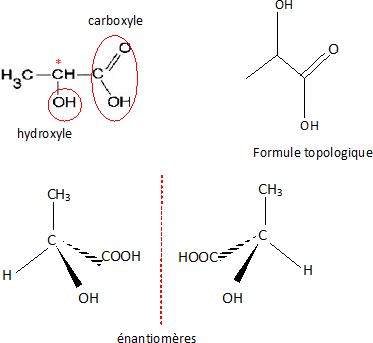
L’acidogenèse permet également de former de l’acide lactique, de
formule semi-développée : CH3-CH(OH)-COOH.
1.6. Écrire la
formule topologique de la molécule d’acide lactique et entourer les
groupes caractéristiques.
Nommer les familles associées à ces groupes caractéristiques.
Fonctions acide carboxylique et alcool secondaire.
1.7. Utiliser la
représentation de Cram pour représenter les énantiomères de la molécule
d’acide lactique.
|
2. Aspect énergétique de la méthanisation.
Données :
- à 20 °C, le volume occupé par une mole de gaz est Vm =
0,024 m3.mol-1;
- 1 kWh = 3600 kJ ;
- consommation énergétique annuelle moyenne par habitant : Ehab
= 1,0 MWh ;
- énergie libérée par la combustion d’une mole de méthane : Emeth
= 838 kJ.mol-1.
Le « biogaz » est essentiellement constitué de méthane et peut servir à
produire de l’électricité. Le résidu de la méthanisation, appelé «
digestat », peut être utilisé comme engrais pour l’agriculture. L’un
des avantages du procédé de méthanisation est la valorisation du «
biogaz », constitué à 60 % de méthane CH4(g) en volume. Une
usine de méthanisation produit annuellement 750 000 m3 de «
biogaz ».
On négligera l’apport énergétique des autres combustions éventuelles.
Estimer le nombre d’habitants dont la consommation énergétique annuelle
serait couverte par cette usine de méthanisation.
Volume de méthane : 0,60 x750 000 = 450 000 m3.
Quantité de matière correspondante ( mol) : n = 450 000 / 0,024 = 1,875
107 mol.
Energie libérée par combusrion : 1,875 107 x 838 =1,57
1010 kJ.
1,57 1010 / 3600 =4,36 106 kWh = 4,36 103
MWh.
Nombre d'habitants : ~ 4400.
|
|