Le miel est un mélange de
composition complexe.
Il est constitué principalement de sucres, dont le fructose et le
glucose, d’eau, ainsi que d’autres substances, telles que des acides
organiques, des enzymes et des particules solides provenant de sa
récolte.
1. Le miel : un composé
riche en sucres.
Lorsque les abeilles ouvrières rapportent le nectar à la ruche, elles
le transmettent à des receveuses par trophallaxie (bouche-à-bouche).
Celles-ci le font alors transiter plusieurs fois entre leur bouche et
leur jabot (petite poche servant de réservoir à nectar) puis le donnent
à d’autres receveuses et ainsi de suite. Sous l’effet de l’invertase,
une enzyme présente dans le jabot des abeilles, les sucres sont
lentement modifiés : le saccharose est hydrolysé en fructose et
glucose. Le nectar se transforme ainsi en miel.
D’après le site www.insectes.org
Espèce
chimique
|
Saccharose
|
D-glucose
|
D-fructose
|
eau
|
Masse
molaire g/mol
|
342
|
180
|
180
|
18
|
Représentation
topologique
|
|
|
|
|
Masse volumique de
l’eau : ρ = 1,0 g.mL
-1 ;
Solubilité du saccharose dans l’eau à 20° C : 2,0 kg.L
-1
environ.
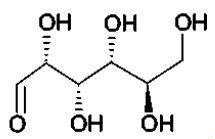
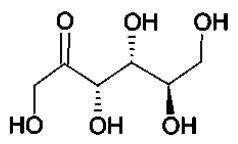
1.1. Molécules de
glucose et de fructose.
1.1.1. Déterminer
les formules brutes du D-glucose et du D-fructose.
C6H12O6.
1.1.2. Quels sont
les points communs entre ces deux molécules ? Quelles sont les
différences ? En déduire la relation qui les lie.
Points communs : même formule brute ; 5 fonctions alcools et un groupe
carbonyle.
Différence : le fructose possède une fonction cétone ; le glucose
possède une fonction aldehyde, c'est un réducteur.
Fructose et glucose sont des isomères de position d'une fonction.
1.2. L’hydrolyse du
saccharose
Sous l’effet de l’invertase, le saccharose de formule brute est C
12H
22O
11
se transforme en glucose et en fructose dans le jabot des abeilles.
1.2.1. Modéliser, à
l’aide des formules brutes, la transformation par une équation
chimique. Vérifier qu’il s’agit bien d’une hydrolyse.
C12H22O11 +H2O ---> C6H12O6
+C6H12O6 .
L'eau réalise une coupure d'une liaison C-O du saccharose.
1.2.2.
L’invertase est le catalyseur de la réaction d’hydrolyse du saccharose.
Citer les différents types de catalyse. Quel type de catalyse est mis
en oeuvre pour cette hydrolyse dans le jabot des abeilles ?
Catalyse homogène ; catalyse hétérogène ; catalyse enzymatique dans le
cas de l'hydrolyse du saccharose.
1.2.3. Les abeilles
n’hibernent pas, elles hivernent. Bien que leur activité soit ralentie,
elles s’alimentent en consommant le miel stocké dans la ruche. Quand le
stock est insuffisant, il faut les nourrir avec des sirops dont la
composition est proche de celle d’un miel. Un apiculteur amateur
prépare un « sirop léger » par dissolution de 0,50 kg de saccharose
dans 1,0 L d’eau à 20 ° C et l’introduit dans une ruche.
Déterminer la masse de glucose qui sera disponible pour les abeilles
lorsqu’elles auront consommé le sirop.
Quantité de matière de saccharose = quantité de matière de glucose =
500 /342 =1,462 mol.
Masse de glucose : 1,462 x 180 ~
2,6 102 g.
1.3. Le
glucose est susceptible de fermenter : des microorganismes (levures)
produisent une enzyme la zymase qui, par des réactions complexes,
conduit le glucose à se décomposer. Cette décomposition est modélisée
par l’équation suivante :
Glucose --->2 C
2H
6O + 2 CO
2.
Le spectre RMN du proton, reproduit ci-dessous, est celui du produit C
2H
6O
formé par fermentation. Donner la formule semi-développée de ce
produit. Justifier votre démarche.
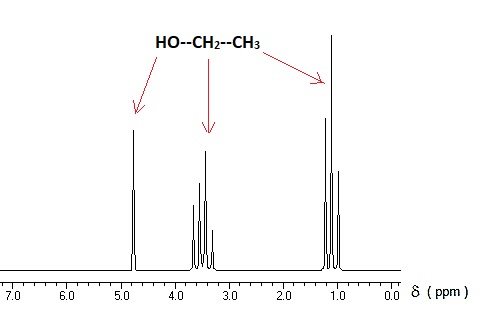
Le proton alcoolique apparaît sous forme d'un singulet.
Les protons du groupe CH
3 apparaissent sous forme d'un
triplet, le carbone voisin portant deux protons.
Les protons du
groupe CH2 apparaissent sous forme d'unquadruplet, le
carbone voisin portant trois protons.