Optique,
électricité, chimie organique.
Concours ITRF Versailles 2016 .
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
Optique. 16 points
Un
faisceau LASER monochromatique de longueur d’onde dans le vide λ 0 = 650
nm et se propageant dans l’air, est dirigé sur un fil vertical, de diamètre a (a est de
l'ordre du dixième de millimètre). On place un écran à une distance D de ce fil; la distance D est grande devant a.
1. Parmi les photos suivantes, laquelle correspond à ce que l’on obtient à l’écran.
2. Indiquer à quel phénomène on peut associer chaque photo.

3. On dit que la lumière émise par la source laser est monochromatique.
Quelle est la signification de ce terme?
La lumière possède une seule fréquence, un seule couleur.
4. Quel caractère de la lumière l’apparition de ces figures met-elle en évidence ? Caractère ondulatoire de la lumière.
5. Dans quelle condition ces phénomènes sont-ils observables ?
Interférences : les sources doivent être cohérentes et synchrones.
Diffraction : la dimension de l'objet ou de l'ouverture doit être de l'ordre de grandeur de la longueur d'onde de la lumière.
6. Une onde lumineuse est caractérisée par une périodicité spatiale et temporelle.
Nommer ces périodicités et préciser leur unité. T, période temporelle ( s), inverse de la fréquence ( Hz).
l : période spatiale ou longueur d'onde ( m).
7. Rappeler la relation qui lie la longueur d’onde dans le vide, la célérité de la lumière c dans le vide et la période T.
l = cT.
8. Exprimer puis calculer la valeur de la fréquence correspondante.
f = c / l = 3 108 / (650 10-9)=4,6 1014 Hz.
9. Exprimer puis calculer l’énergie associée à un photon laser de fréquence f.
E = h f = 6,63 10-34 x4,6 1014 =3,06 10-19 J.
10. Exprimer l’écart angulaire q en fonction des grandeurs L et D sachant que pour de petits angles exprimés en radian : tanq = q.
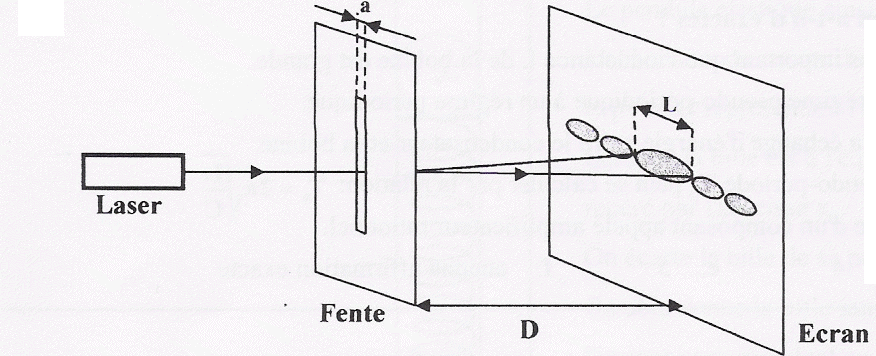
tan q = ½L / D ; tan q ~qq ( en radian) si l'angle est petit.
q~ ½L / D.
11. Montrer que la largeur L de la tache centrale s’exprime par: L = 2 lD /a.
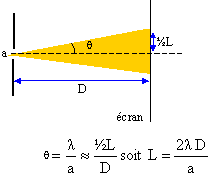
12. Sachant que D = 2,0 m et L = 3,2 cm, calculer la largeur a du fil.
a = 2 lD / L =2 x650 10-9 x2 / 0,032=8,1 10-5 m.
|
|
|
Electricité: 14 points
1.
Dessiner le montage qui permettra de tracer la caractéristique d’une
diode. Veillez à flécher et annoter les différentes intensité et
tensions sur le schéma (pensez à indiquer la borne « COM » des
multimètres).
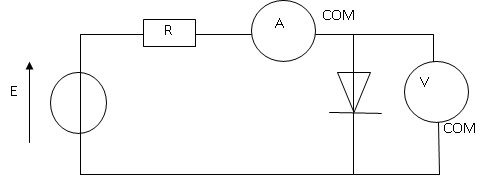
2. A quoi sert le conducteur ohmique ?
Il protège la diode contre les surintensités..
3. Trois photos de résistances sont données.
Déterminez leur valeur à l’aide du code couleur.
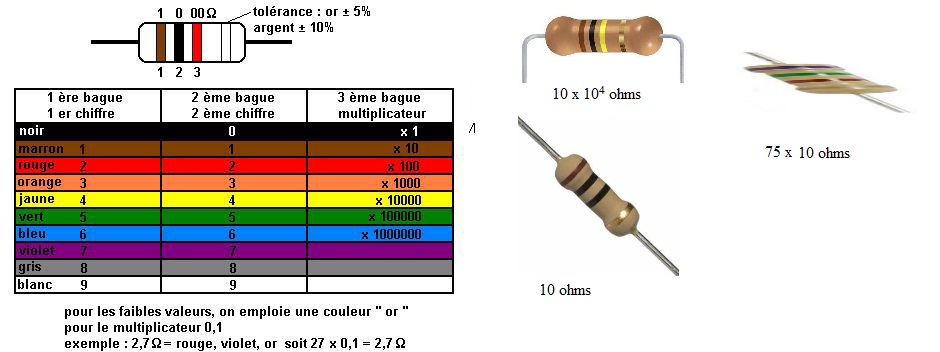
4. Sachant que le
générateur peut délivrer une tension de 15 V, qu’il est considéré comme
idéal, que l’on peut considérer comme nulle la résistance de la diode,
quel conducteur ohmique choisiriez-vous parmi les trois proposés ?
Justifiez votre réponse.
Intensité maximale admissible pour la diode : 1 A.
La résistance minimale du conducteur ohmique doit être de 15 ohms.
5. Distinguer
sur la figure 1 ci-dessous les différents modes de fonctionnement de la
diode. Décrire ces modes. Proposer une méthode pour trouver la tension
seuil (vous pouvez dessiner directement sur la figure).
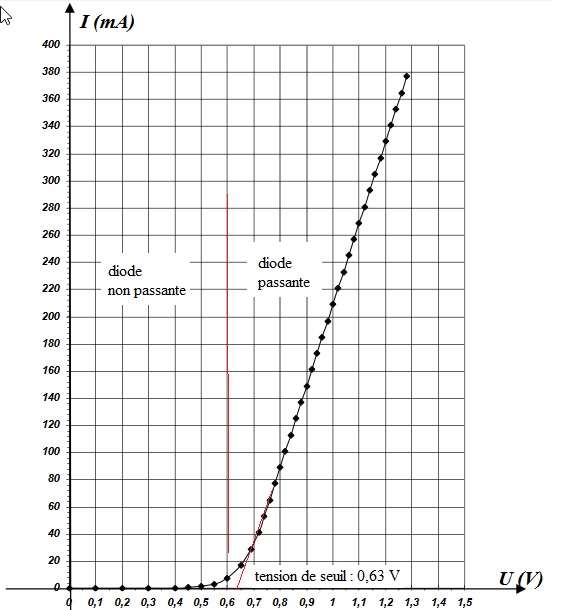
|
|
|
|
Synthèse de la lidocaïne. 28 points.
La lidocaïne est un anesthésique local dont l’effet est rapide (au bout d’une minute) et de longue durée
(environ 1h). La formule semi-développée de la lidocaïne est représentée ci-dessous.
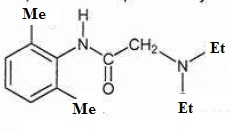
1. Questions générales
a. Donner la formule correspondant aux groupes chimiques Me et Et ?
Me : méthyle CH3 ; Et : éthyle CH2 CH3.
b. Ecrire la formule développée de la lidocaïne en faisant apparaître tous les protons, tous les doublets liants et non liants.
c. Quels sont les groupes caractéristiques de la lidocaïne ? Les entourer sur la formule développée que vous avez écrite en 2).
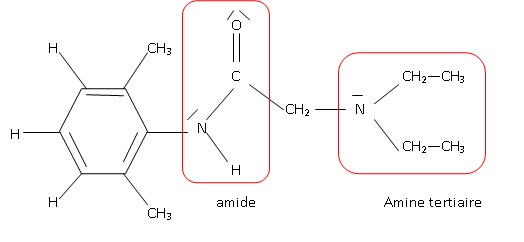
d. Indiquer l’item exact
- Selon la nomenclature IUPAC, la lidocaïne est le 2,6-diméthyl-2[(diméthylamino)méthyl)]- benzamide
- Selon la nomenclature IUPAC, la lidocaïne est le 2-diéthylamino-N-(2,6- diméthylphényl)éthanamide). Vrai.
- Les deux items ci-dessus sont faux.
e. La lidocaïne peut être synthétisée en deux étapes. Donner la structure du composé A.
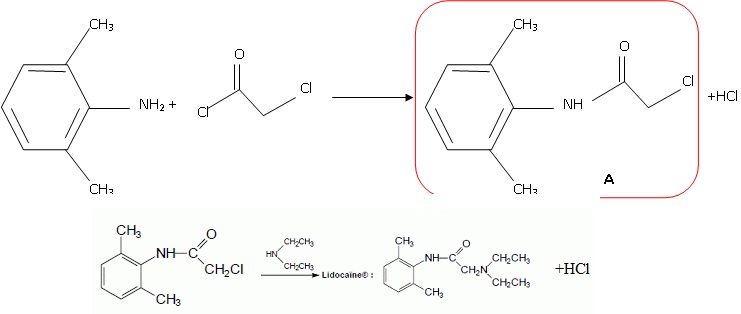
La première étape correspond à une réaction de substitution.
La deuxième étape correspond à une réaction de substitution.
2. a. Compléter directement dans l’extrait en anglais les valeurs manquantes indiquées avec le symbole ……..
b. Traduire en français la première étape de la synthèse
2,6-Dimethylaniline (3.0 mL, ………. g, ……….. mmol) is added to 15 mL of glacial acetic acid in a
125-mL Erlenmeyer flask followed by chloroacetyl chloride (2.0 mL, …….…. g, ………… mmol)
and 25 mL of half-saturated aqueous sodium acetate.
Precipitation of the amide is virtually instantaneous. The product is stirred thoroughly with 60 mL of
cold water and isolated by vacuum filtration. It should be pressed as dry as possible in the Buchner
funnel and used immediately in the next step.
2,6-diméthylaniline( 3,0 mL, g , mmol est ajouté à 15 mL d'acide
acétique glacial dans un erlenmeyer de 125 ml suivi d 'un chlorure de
chloroacéthyle ( 2,0 mL, , ) et 25 mL d'acétate
de sodium aqueux semi-saturé. La précipitation de l'amide est quasiment
instantané. Le produit est agité à fond avec 60 mL d'eau froide
et isolé par filtration sous vide. Il doit être pressé aussi sec que
possible dans le Buchner. l'entonnoir est utilisé immédiatement dans
l'étape suivante.
3,0 mL , 3,0 x densité = 3,0 x 0,707 =2,12 g ; 2,12 / masse molaire = 2,12 / 73,14=0,029 mol = 29 mmol.
2,0 mL ; 2,0 x 1,417 =2,834 g ; 2,834 / 112,84 =0,025 mol = 25 mmol.
c. Afin
d’évaluer l’avancement de la réaction au cours de la deuxième étape, on
effectue une chromatographie sur couche mince. On réalise quatre
prélèvements (1) (2) (3) (4) du mélange réactionnel à différents temps
: t1 = 0 min ; t2 = 20 min ; t3 = 60 min ; t4
= 90 min. Ces quatre prélèvements sont placés au fur et à mesure dans
une enceinte à basse température. Le dernier prélèvement étant
effectué, on réalise la chromatographie de chacun des prélèvements sur
une même plaque de silice. On obtient le chromatogramme ci-dessous.
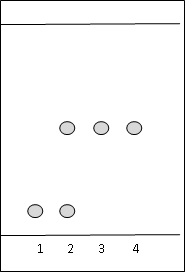
Rappeler le principe d’une chromatographie sur couche mince.
But : séparer et identifier les constituants d'un mélange.
Mise en oeuvre : placer l'éluant dans le bécher ( hauteur 5 mm), mettre un couvercle.
Sur la plaque CCM, tracer 2 traits au crayon de papier à 7 ou 8 mm des extrémités.
Sur le trait inférieur faire les dépots (pipette pasteur), espèces à analyser et substances étalon.
Placer la plaque dans le bécher, fermer, retirer dés que l'éluant atteint le trait supérieur.
d. Pourquoi place-t-on les prélèvements dans une enceinte à basse température ?
On réalise un blocage cinétique.
e. D’après le chromatogramme, à partir de quel temps peut-on considérer avec certitude que la réaction est terminée ? Justifier.
A partir de 60 min, le chromatogramme présente une seule tache, celle du produit.
f. Cette synthèse permet d’obtenir 4,1 g de lidocaïne. Calculer le rendement global de la synthèse.
Le chlorure de chloroacéthyle est en défaut. On peut obtenir au mieux
25 mmol de lidocaïne soit 0,025 x234,3 =5,88 g.
Rendement : 4,1 / 5,88 ~0,70 ( 70 %).
3. Pommade avec de la lidocaïne.
Il existe une pommade hydrophile contenant 5 % de lidocaïne dont
l’excipient (mélange polyéthylène glycol – propylène glycol) est
miscible dans l’eau. Cette pommade est utilisée comme anesthésique
local. Le dosage du principe actif (la lidocaïne) de cette pommade peut
être réalisé par un dosage par spectrométrie UV-Visible en réalisant au
préalable une courbe d’étalonnage avec des solutions étalons. Le
solvant utilisé est de l’acide chlorhydrique 0,1 mol. L-1 et la mesure des absorbances s’effectue à une longueur d’onde l = 263 nm.
a. Enoncer la loi de Beer-Lambert .On précisera les unités.
b. Indiquer au moins deux conditions de validité de la loi de Beer-Lambert
A= log (I0/I) = elc ( A est l'absorbance ou densité optique)
Cette loi est vérifiée lorsque la solution est de concentration inférieure à : c < 0,1 mol.L-1 et pour des absorbance inférieures à 1.
e (L mol-1 cm-1) est une caractéristique de la molécule. Plus e sera grand, plus la solution absorbe.
l est l'épaisseur de la cuve (cm) et c la concentration de la solution (mol/L).
c. Expliquer le principe d’un dosage par étalonnage. On représentera l’allure de la courbe d’étalonnage.
La méthode
de dosage nécessite de préparer une échelle de teintes, c'est à dire un
ensemble de solutions étalons ( de concentrations connues) ; puis on
mesure l'absorbance de chaque solution étalon et de la solution dont on
veut déterminer la concentration. La courbe d'étalonnage est une droite
passant par l'origine.
|
Analyse physico-chimique. 7 points.
Un étudiant a caractérisé un produit par trois différentes techniques. Les résultats sont présentés ci-dessous.
1. Malheureusement
cet étudiant est incapable de préciser la technique d’analyse utilisée
pour chaque résultat. Indiquer lui ces techniques.
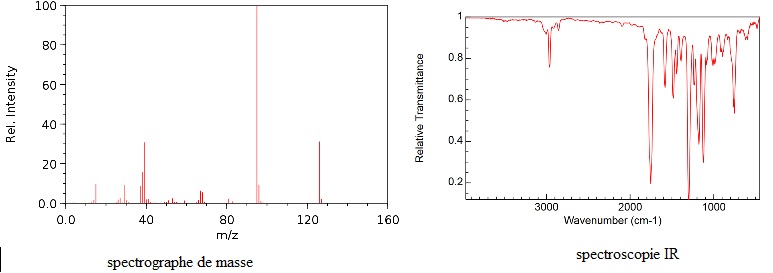
RMN du proton.
7,51 ppm, 1 proton, quadruplet ; 7,02 ppm, un proton , quadruplet ;
6,45 ppm, 1 proton, quadruplet ; 3,80 ppm, 3 protons, singulet.
2. Analyse du premier spectre.
a. Quelle est la masse du pic de base sur le premier spectre ? Préciser à quoi il correspond.
m / z = 95. Il correspond à l'ion le plus abondant et le plus stable.
b. Quelle est la masse de l’ion moléculaire observé ?
m / z = 126.
3. Analyse du second spectre.
a. Proposer deux groupes fonctionnels présents dans le produit ? Justifier.
Le pic intense vers 1700 cm-1 indique la présence de C=O.
3000 cm-1 : C-H aromatique.
4. Analyse du troisième spectre
Que signifie
d : déplacement chimique
Quadruplet : le groupe de protons équivalents donne 4 pics ; le carbone voisin compte 3 ptotons équivalents.
Intensité = 3 : 3 protons équivalents sur le même carbone.
L’eau oxygénée (12 pts)
L'eau oxygénée est une solution aqueuse de peroxyde d'hydrogène, H2O2 qui peut se décomposer très lentement en eau et dioxygène. Cette réaction fait intervenir les deux couples :
H2O2 (aq) /H2O ; O2 (aq) / H2O2 (aq).
1. Ecrire la réaction de décomposition de l’eau oxygénée. Indiquer les produits et les réactifs.
Réactif : H2O2 aq ; produits : H2O ; O2 (aq).
2H2O2 aq---> 2 H2O+O2 (aq).
2. Ecrire les structures de Lewis des produits.
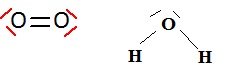
3. Cette réaction de décomposition est :
- Une réaction acido-basique ; - Une réaction de dismutation ( vrai).
- Une réaction de précipitation ; - Une réaction d’élimination
4. Cette réaction
est très lente et peut être catalysée par l’ion fer(III) en ajoutant à
la solution d’eau oxygénée une solution de chlorure de Fe(III).
Un catalyseur accèlère la réaction; il est régénéré à la fin et n'intervient pas dans le bilan.
b. La catalyse mise en jeu est-elle homogène ou hétérogène ? Justifier.
Catalyse homogène : catalyseur et réactif sont dans la même phase.
5. Pour réaliser cette expérience, vous devez commander de l’eau oxygénée à 30 % en masse.
Deux fournisseurs proposent de l’eau oxygénée avec les caractéristiques suivantes :
A : 30 % en masse ; B Titre (en volume) = 110 , Densité = 1,11
On rappelle que le titre en "volume" est le volume de dioxygène mesuré
en litre que peut théoriquement dégager 1 L d'eau oxygénée par
décomposition totale, dans les conditions normales de température et
pression.
Le volume molaire Vm = V/n = RT/P (en supposant le dioxygène comme un gaz parfait) = 22,4 L.mol-1.
Le fournisseur B fournit-il de l’eau oxygénée à 30 % en masse ? Justifier votre réponse.
1 L d'eau oxygénée peut dégager 110 volumes de dioxygène soit 110 / 22,4 =4,91 mol.
Quantité de matière d'eau oxygénée dans 1 L : 2 x4,91 = 9,82 mol soit en masse : 9,82 x34 ~334 g.
Masse de 1 L de solution 1,11 kg ; pourcentage massique en eau oxygénée : 334 / 1110 = 0,30 ( 30 %).
|
|