Du
vin au vinaigre, bac S Nlle Calédonie 2018.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
.
.
|
......
.....
|
On
peut produire du vinaigre à partir de différentes boissons alcoolisées
comme le vin ou le cidre. En présence de dioxygène, l’éthanol C2H6O, contenu dans un vin ou un cidre est transformé en acide éthanoïque C2H4O2 (également
appelé acide acétique) et en eau. Cette réaction, appelée fermentation
acétique, est catalysée par une enzyme présente dans la bactérie
Mycoderma Aceti.
L’objectif de cet exercice est l’étude de la transformation de
l’éthanol en acide acétique et la détermination du degré alcoolique du
vin qui a permis la fabrication d’un vinaigre. On considère que cette
transformation est totale, et qu’elle s’effectue à volume constant.
Données :
masses molaires atomiques : M(H) = 1,0 g.mol-1 ; M(C) = 12,0 g.mol-1 ; M(O) = 16,0 g.mol-1 ;
masse volumique de l’éthanol à température ambiante : ρ(éthanol) = 0,79 g.mL-1 ;
le degré d’acidité d’un vinaigre (en °) correspond à la masse
d’acide éthanoïque pur (en g) contenue dans 100 g de vinaigre soit
environ 100 mL de vinaigre. Par exemple, un vinaigre à 10° contient 10
g d’acide éthanoïque pour 100 g de vinaigre ;
le degré alcoolique d’un vin (en °) correspond au volume d’éthanol pur (en mL) contenu dans 100 mL de vin.
1. De l’éthanol à l’acide éthanoïque
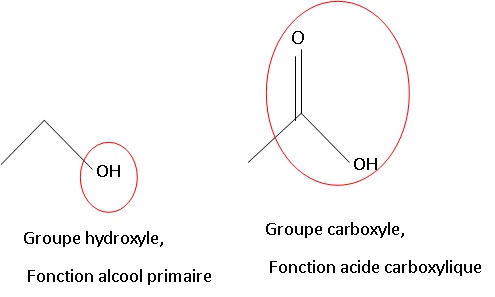
1.1. Représenter les formules topologiques de l’éthanol et de l’acide éthanoïque.
1.2. Entourer les
groupes caractéristiques sur les formules topologiques précédentes.
Nommer les familles chimiques associées à ces groupes.
1.3. Écrire l’équation de la réaction de fermentation acétique.
C2H6O + O2 ---> C2H4O2 +H2O.
1.4. Indiquer si le spectre infrarouge ci-après est celui de l’éthanol ou celui de l’acide éthanoïque. Justifier.
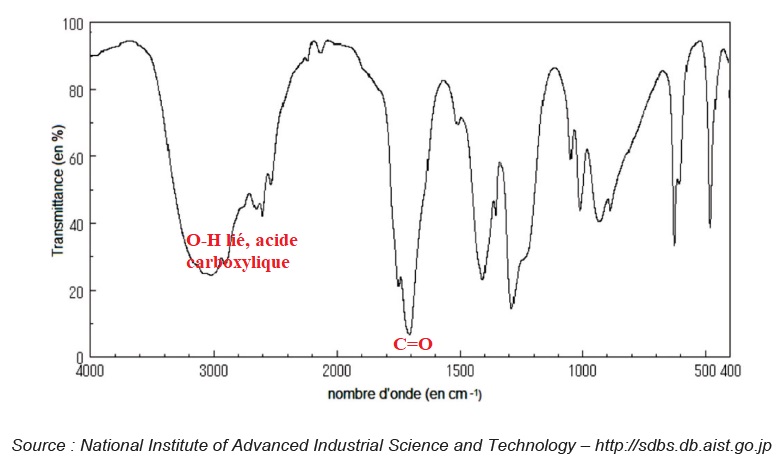
La présence de la bande étroite et forte vers 1700 cm-1 confirme le spectre IR de l'acide carboxylique. Ce pic serait absent sur le spectre IR de l'éthanol.
|
...
|
|
.
|
....
|
1.5. Le pH d’une solution aqueuse d’acide éthanoïque de concentration molaire 2,5 mmol.L-1 est égal à 3,7.
L’acide éthanoïque est-il un acide fort ? Justifier.
Si l'acide étnanoïque était fort, le pH de cette solution serait égal à pH = -log C = -log(2,5 10-3) =2,6.
Or le pH mesuré est supérieur à 2,6, l'acide acétique est qualifié d'acide faible.
2. Degré alcoolique du vin blanc ayant servi à fabriquer un vinaigre
2.1. Montrer que la fermentation acétique de 1,0 g d’éthanol permet d’obtenir 1,3 g d’acide éthanoïque.
Quantité de matière d'éthanol n = 1,0 / M(éthanol) = 1,0 / 46 ~0,0217 mol.
Quantité de matière d'acie éthanoïque n = 0,217 mol.
M( acide éthanoïque) = 2 x12 +4 +2 x16 = 60 g / mol.
Masse correspondante d'acide éthanoïque : 60 x0,0217 ~ 1,3 g.
2.2. Déterminer le degré alcoolique du vin qui a permis d’obtenir le vinaigre de vin blanc dont l’étiquette est :

Le vinaigre à 6 degrés contient 6,0 g d'acide acétique dans 100 g de vinaigre ( soit dans environ 100 mL de vinaigre).
Quantité de matière d'acide acétique dans 100 mL de vinaigre : 6 / 60 = 0,1 mol.
Quantité de matière d'éthanol oxydée : 0,1 mol.
Masse d'éthanol : 0,1 x46 = 4,6 g.
Volume d'éthanol : 4,6 / r(éthanol) = 4,6 / 0,79 = 5,8 mL. dans 100 mL ( soit 5,8 ° ).
|
|


