Le manioc,
Bac S Liban 2018
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
.
.
|
|
Le
manioc contient des hétérosides cyanogènes à l'intérieur des cellules
de tous ces tissus. L'altération des parois cellulaires de la plante
provoque une réaction dhydrolyse qui génère entre autre du cyanure
d'hydrogène HCN. Les ions cyanure présentent une forte affinité avec le
fer de l'hémoglobine empéchant la fixation du dioxygène.
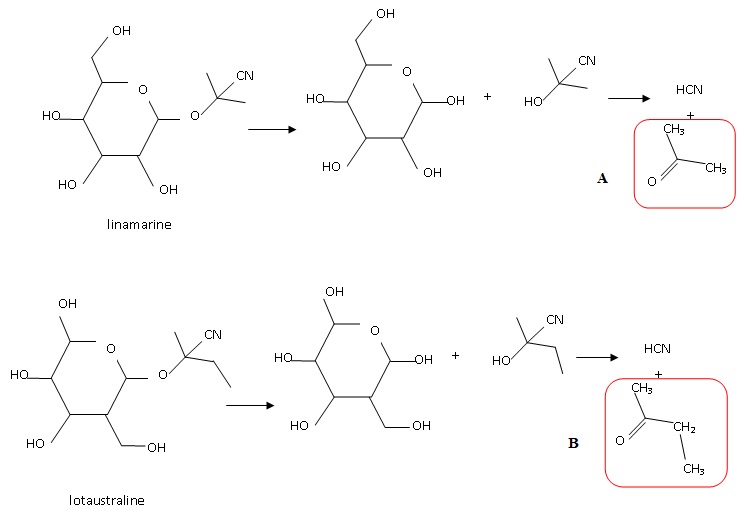
1.1 Donner la formule semi-développée des composés obtenus avec le cyanure d'hydrogène après dégradation enzymatique.
1.2
Le spectre RMN des composés A ( ontenu majoritairement )ou B présente
un seul signal sous forme d'un singulet. Identifier ce composé.
Seul
le composé A possède 6 protons équivalents ; de plus le carbone voisin
ne porte aucun hydrogène. Les protons de A donnent un seul signal, un
singulet.
Le composé B comporte trois types de protons, ce qui conduit à trois signaux.
1.3 En déduire quel hétéroside est principalement présent dans la racine de manioc.
La linamarine.
|
|
|
|
|
2. Titrage iodométrique des ions thiosulfate.
L'un
des kits de traitement d'urgence des intoxications par les
cyanures comporte, entre autre, des fioles de solution aqueuse de
thiosulfate de sodium pour injection contenant 12,5 g de thiosulfate de
sodium dans 50 mL d'eau stérile.
Thiosulfate de sodium Na2 S2O3.
En solution aqueuse le diode réagit avec les ions thiosulfate.
I2(aq) + 2S2O32-aq ---> 2I-aq + S4O62-aq.
2.1. L'ion thiosulfate est un réducteur. Ecrire les couples oxydant / réducteur mis en jeu.
S4O62-aq / S2O32-aq.
I2(aq) / I-aq.
2.2 Ecrire les demi-équations électroniques associées à ces couples.
S4O62-aq +2e- = 2S2O32-aq.
I2(aq) +2e-= 2 I-aq.
2.3 Calculer la quantité de matière de thiosulfate contenue dans une fiole d'antidote.
Masse molaire Na2 S2O3 : M = 2 x23 +2x32,1 +3x16 = 158,2 g/mol.
Quantité de matière ; n = 12,5 / 158,2 =0,0790 mol.
|
|
2.4. Proposer un protocole de titrage de la solution aqueuse de thiosulfate de sodium présente dans la fiole du kit antidote.
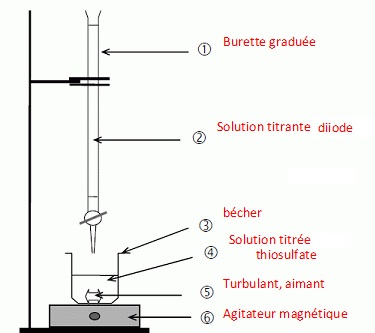
Concentration de cette solution de thiosulfate : 0,0790 / 0,050 =1,58 mol/L.
Concentration de la solution de diiode : 0,100 mol/L.
Il faut donc diluer 10 fois la solution de thiosulfate du kit.
Prélever 10,0 mL de cette solution de thiosulfate ( pipette jaugée de 10,0 mL) que l'on place dans une fiole jaugée de 100,0 mL.
Compléter avec de l'eau distillée jusqu'au trait de jauge, boucher,et agiter pour rendre homogène.
Prélever 10,0 mL de cette solution diluée, placer la dans un bécher et ajouter un peu d'ampois d'amidon.
Comment repérer l'équivalence ?
Avant l'équivalence, le diiode est en défaut.
Après l'équivalence, le diiode est en excès ; il donne une coloration de couleur bleue en présence d'empois d'amidon..
|
|