Physique
chimie, procédé industriel de synthèse de l'ETBE,
Bac SPCL Métropole 2018
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
|
|
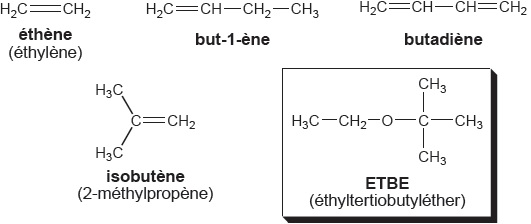
A. Transformation du butadiène en but-1-ène et synthèse de l’ETBE .
Le mélange brut issu du pétrole contient plusieurs composés mais seuls
le but-1-ène et l’isobutène peuvent être utilisés pour la production
d’ETBE. L’éthène est séparé du mélange et le butadiène est transformé
en but-1-ène.
Dans cette partie sont étudiées les synthèses du but-1-ène (dans le réacteur R1) et de l’ETBE (dans le réacteur R2).
Dans le réacteur R1, le butadiène est dissous dans le diméthylformamide (DMF, solvant de la réaction) puis réagit avec du dihydrogène H2
pour conduire à la formation de but-1-ène. Le DMF reste liquide dans
les conditions de température (250 °C) et de pression (environ 20 bars)
utilisées. Le catalyseur utilisé est du palladium adsorbé sur de
l'alumine Al2O3(s), à raison d'environ 1 %.
Les questions de cette partie ont pour objectif d’étudier la réaction
mise en jeu et de déterminer la masse de but-1-ène produite en une
heure.
La vitesse v de formation du but-1-ène, à 250 °C, pour 1 kg de catalyseur, est donnée par :
v = 0,923 x Cbut x CH2½.
Les concentrations en butadiène et dihydrogène sont en mol L-1 ; v en mol s-1 par kg de catalyseur
A.1. Catalyse de l’hydrogénation partielle du butadiène (réacteur R1).
A.1.1. Donner la définition d'un catalyseur.
Un
catalyseur est une espèce chimique accélère une réaction
thermodynamiquement possible ; il est régénéré dans la dernière étape
et n'apparaît pas dans le bilan.
A.1.2. D’un point de vue énergétique, donner la raison pour laquelle un catalyseur modifie la vitesse d'une transformation chimique.
Le catalyseur diminue l'énergie d'activation de la réaction.
A.1.3. Préciser s’il s'agit d'une catalyse homogène ou hétérogène. Justifier.
Catalyse hétérogène : le catalyseur est un solide ; la réaction s'effectue dans un solvant liquide avec le dihydrogène gazeux.
A.2. Réaction d’hydrogénation partielle du butadiène (réacteur R1)
A.2.1. Écrire
l'équation de la réaction de transformation du butadiène en but-1-ène
(les formules semi-développées sont données dans l’introduction).
H2C=CH--CH=CH2 + H2 ---> CH3--CH2--CH=CH2.
A.2.2. Calculer la
vitesse de la réaction, par kilogramme de catalyseur, sachant que, dans
les conditions de température et de pression utilisées, la
concentration en butadiène vaut Cbut = 0,203 mol L-1 et celle de dihydrogène CH2= 0,271 mol L-1.
v = 0,923 x 0,203 x 0,271½ ~9,75 10-2 mol s-1 par kg de catalyseur
A.2.3. Vérifier que la masse de but-1-ène (M = 56,10 g mol-1) produite à l'heure, est supérieure à 15 kg par kilogramme de catalyseur.
9,75 10-2 x 56,1 x 3600 = 1,97 104 g = 19,7 kg.
Le DMF et le but-1-ène sont ensuite séparés par distillation. Le DMF est recyclé.
A.3. Synthèse de l’ETBE (réacteur R2)
Le mélange de but-1-ène et d'isobutène est injecté, ainsi que de l'éthanol, dans un réacteur à remplissage (R2). Celui-ci contient un catalyseur, de la Lewatit K2631, qui est une résine sulfonique très poreuse : elle apporte les ions H+ nécessaires pour la réaction entre l'isobutène et l'éthanol qui donne l'ETBE.
Le mécanisme de la réaction est présenté dans le document 2 (page 7).
La température d'injection des réactifs est de 70 °C. Le débit est
réglé pour que la température de sortie soit de 120 °C, limite
d'utilisation de la résine. La pression dans le réacteur R2 est de 20 bars.
A.3.1. Préciser si le processus mis en jeu dans le réacteur R2 est globalement endothermique ou exothermique. Justifier.
Processus exothermique : la température de sortie est supérieure de 50 °C à la température d'entre.
A.3.2. Écrire l’équation de réaction traduisant le bilan des trois étapes présentées.
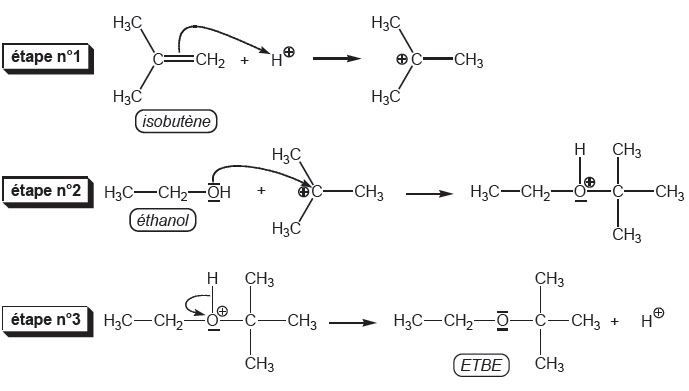
(CH3)2C=CH2 + CH3--CH2--OH --->(CH3)3C--O--CH2--CH3.
A.3.3. Parmi les dénominations suivantes, choisir celle qui définit la réaction de l’étape 2 :
élimination – substitution – addition – acide/base.
|
|
|
|
|
B. Régulation de température et contrôles analytiques.
Dans cette partie sont étudiées :
- la régulation de température à la sortie du réacteur R2,
- la composition des liquides à la sortie du réacteur R2 et de la colonne de distillation.
Pour rappel, la température de sortie du réacteur R2 doit
être maintenue à 120 °C en agissant sur le débit d'entrée. Pour cela on
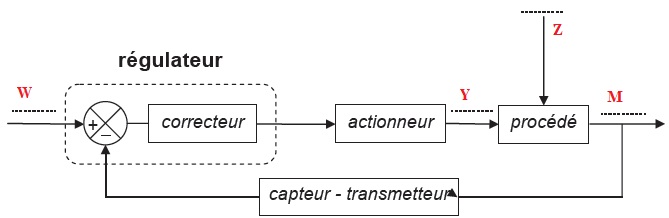
utilise une boucle de régulation dont le schéma de principe est donné.
B.1. Régulation de la température en sortie du réacteur R2.
B.1.1. Parmi les termes ci-dessous, identifier la perturbation Z, la grandeur réglée M et la grandeur réglante Y :
Grandeur réglée M : température du mélange de sortie ;
Grandeur réglante Y : débit du mélange d’entrée.
perturbation Z : température du mélange injecté.
B.1.2. Donner la grandeur physique associée à la consigne W.
La consigne est la température 120 °C.
B.1.3. Compléter le schéma avec les 4 termes (Z, M, Y et W).
Industriellement, on fait appel à un capteur-transmetteur pour
convertir la température T (0 à 500 °C) en intensité électrique i (4 à
20 mA).
Pour déterminer la précision du capteur-transmetteur, on réalise n
essais consécutifs (n = 6) à la température de 100 °C. Les résultats
sont rassemblés dans le tableau ci-dessous :
Essais
|
1
|
2
|
3
|
4
|
5
|
6
|
i(mA)
|
7,18
|
7,21
|
7,19
|
7,20
|
7,18
|
7,17
|
Pour un mesurande X, l’incertitude est donnée par : U(X) = k s(X) / n½.
où n est le nombre de mesures effectuées, s(X) l’écart-type et k le coefficient de Student.
Pour les 6 mesures effectuées, un niveau de confiance de 95 % correspond à k = 2,57.
B.1.4. Déterminer la moyenne i des valeurs du tableau ci-dessus.
imoyen = (7,18 +7,21 +7,19 +7,20 +7,18 +7,17) / 6 = 7,19.
B.1.5. Déterminer l’incertitude élargie U(i) donnant un intervalle de confiance de 95 %, sachant que l’écart-type vaut s(i) = 1,47 × 10-2 mA.
U(i) = 2,57 x1,47 10-2 / 6½ =1,54 10-2 mA.
B.1.6. Exprimer correctement le résultat sous la forme i = i ± U(i) .
imoyen = 7,19 ±0,02 mA.
B.1.7. Le
constructeur indique sur le capteur-transmetteur une précision de 1 %.
Indiquer si les mesures réalisées sont cohérentes avec cette valeur en
justifiant la réponse.
0,02 / 7,19 = 2,8 10-3 ( 0,28 %). Les mesures sont cohérentes.
|
|
B.2. Contrôle de la composition des liquides en sortie de R2.
Le produit sortant du réacteur R2 contient principalement de l'ETBE, de l'éthanol, du but-1-ène, du but-2-ène (isomères E et Z).
Il est important de pouvoir estimer le taux d’ETBE dans le mélange à la sortie du réacteur R2 pour
gérer au mieux la suite du procédé. La connaissance de l’indice de
réfraction du mélange permet d’accéder au pourcentage massique d’ETBE.
Une partie du dispositif de mesure de l’indice de réfraction est
schématisée : la détection du rayon limite sortant du prisme est
réalisée automatiquement grâce à l'analyse de la plage d'éclairage
d'une barrette CCD. On en déduit la valeur de l'angle r2 qui permet de déterminer la valeur de l’indice de
réfraction n. On considérera que l'indice de réfraction de l'air nair est égal à 1,000.
B.2.1. Compléter le schéma pour faire apparaître l’angle d’incidence i1 et l’angle de réfraction r1 au point d’incidence I.
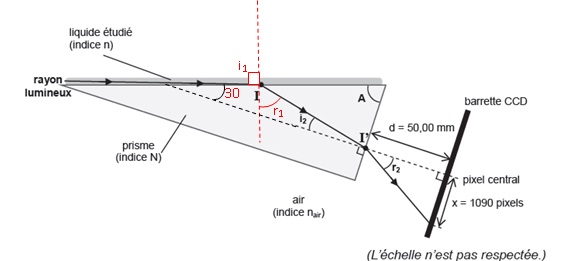
Le prisme utilisé présente un angle au sommet A de 60,00 ° et un indice
de réfraction de valeur N = 1,702. La barrette CCD (3600 pixels, taille
d’un pixel : 8 μm) est située à une distance d = 50,00 mm du prisme.
Lors du fonctionnement, le rayon limite est détecté par le 1090ème pixel situé au-delà du pixel central
B.2.2. Montrer que l'angle r2 vaut 9,89 °.
x = 1090 x 8 10-6 =8,72 10-3 m = 8,72 mm.
tan r2 = 8,72 / 50 = 0,1744 ; r2 = 9,89 °.
B.2.3. Donner l’expression littérale reliant les angles i2 et r2 à l’aide de la deuxième loi de Descartes (ou loi de la réfraction) appliquée au point I’.
Réfraction en I' : N sin i2 = nair sin r2= sin r2 ;
B.2.4.
L’application de la loi de Descartes aux points I et I’ permet de
déterminer l’indice de réfraction n du liquide grâce à la relation
suivante :
n = Nx sin [A-arcsin (sin r2 / N)] ~N x sin(A-5,784)
Faire l’application numérique pour déterminer la valeur de l'indice de réfraction n du liquide sortant du réacteur R2.
n = 1,704 sin (60-5,784) = 1,381.
B.2.5. Déterminer le pourcentage massique en ETBE du produit sortant du réacteur en exploitant et en complétant le graphique suivant.
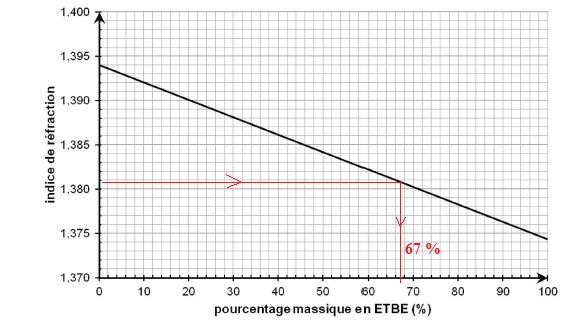
B.3. Contrôle spectroscopique en sortie de colonne de distillation
L’ETBE est ensuite séparé de l'éthanol en excès, du but-1-ène et du
but-2-ène (E et Z) toujours présents, par le biais d’une colonne de
distillation. Pour
vérifier que l’ETBE est effectivement débarrassé de l’éthanol en excès,
on réalise un spectre infrarouge du liquide à la sortie de la colonne
de distillation.
Indiquer si le composé final contient encore de l’éthanol. Justifier la réponse.
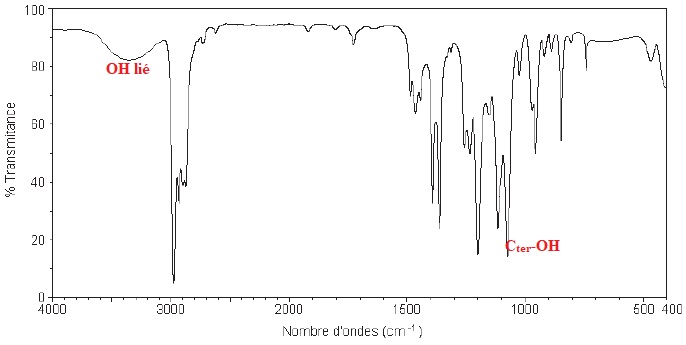
La large bande vers 3300 cm-1 et la bande fine vers 1050 cm-1 traduisent la présence d'éthanol.
C. Effets des additifs dans l’essence (4 points)
C.1. Enthalpie de vaporisation
C.1.1. Définir la notion d’enthalpie massique de vaporisation.
C'est l'énergie qu'il faut fournir à 1 kg de liquide pris à sa
température de vaporisation pour qu'il se transforme en gaz.
C.1.2. Expliquer
pourquoi la forte valeur de l’enthalpie de vaporisation de l'éthanol
peut poser des problèmes de « démarrage à froid », c'est-à-dire lorsque
le moteur du véhicule est encore froid.
A froid, il faut fournir davantage d'énergie à l'éthanol pour le
vaporiser. A chaud , la combustion du mélange carburant air
apporte l'énergie thermique nécessaire.
C.2. Avantages et inconvénients d’un additif
C.2.1. Donner le (ou les) intérêt(s) à introduire un additif (ETBE ou éthanol) à l’essence.
Diminution de la quantité d'essence issue des combustibles fossiles.
L'ETBE ou éthanol ont des indices d'octane plus élevés que l'essence.
C.2.2. Préciser les avantages et les inconvénients de l’ETBE par rapport à l’éthanol.
Les avantages : L'ETBE est miscible à l'essence en toutes proportions.
L'ETBE a une enthalpie de vaporisation inférieure à celle de l'éthanol.
L'éthanol peut s'hydrater, l'ETBE ne le peut pas.
Les inconvénients : l'ETBE est faiblement biodégradable.
L'ETBE est fabriqué à partir de l'éthanol. Sa synthèse nécessite donc davantage d'étapes.
|
|