Chimie,
Concours Puissance alpha 2018
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
|
|
Exercice
1. L’éosine
est un désinfectant en solution dans l’éthanol. Une solution alcoolique
d’éosine est colorée. On place dans un spectrophotomètre une cuve de
largeur l contenant une solution d’éosine de concentration molaire c =
1,0.10-5 mol.L-1.
A température constante, on fait varier la longueur d’onde � (lambda)
et on mesure l’absorbance A, les résultats sont regroupés sur le graphe
ci-dessous
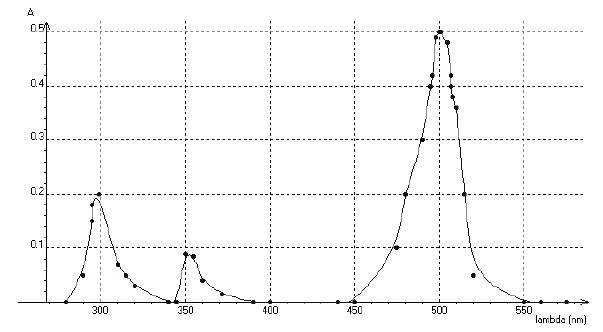
a) Deux longueurs d’onde sur trois correspondent à un maximum d’absorption appartenant à l’infra rouge. Faux.
350 nm ( UV) ; 300 nm ( UV) ; 500 nm ( visible).
b) La solution alcoolique d’éosine est de couleur cyan. Faux.
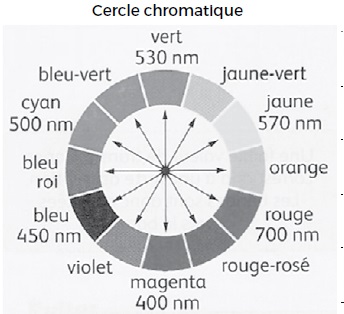
Le maximum d'absorption se situe vers 500 nm. La couleur complémentaire du cyan est le rouge, teinte de la solution.
c) A � = 500 nm, une solution alcoolique d’éosine de concentration molaire c’ = 1,0.10-4 mol.L-1 a une absorbance A’ = 1. Faux.
Absorbance et concentration sont proportionnelles ; c' = 10 c ; A' = 10 x0,5.
d) La transmittance T est une grandeur qui aurait pu être utilisée à la place de l’absorbance. Vrai.
Exercice 2.
L’étude spectroscopique UV-visible d’une solution contenant la molécule
A conduit au spectre de la figure 1. La concentration molaire est c =
2,2.10-5 mol.L-1. A température constante, on trace la courbe d’étalonnage (Figure 2) de cette solution pour une lumière de longueur d’onde �l. Les grandeurs physiques absorbance A et concentration molaire c sont liées par la loi de Beer-Lambert A = �.el.c où � e est le coefficient d’extinction molaire et l la largeur de la cuve.
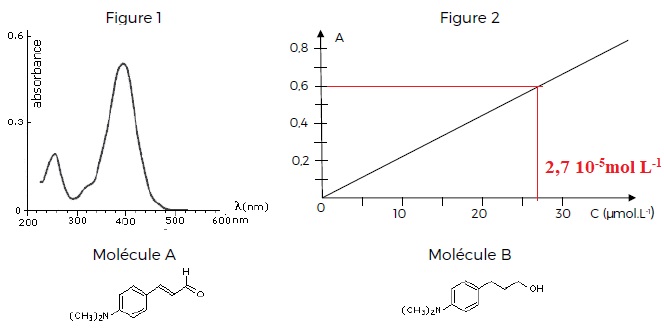
a) La courbe d’étalonnage a été faite à la longueur d’onde l max = 395 nm. Vrai.
La longueur d'onde de travail correspond au maximum d'absorption.
b) Si la largeur l de la cuve du spectroscope double, la valeur du coefficient directeur de la courbe d’étalonnage double. Vrai.
Une transformation chimique de la molécule A conduit en plusieurs étapes à la molécule B.
c) Le spectre UV-visible d’une solution de la molécule B - non
représenté - montre un pic correspondant à un maximum d’absorption à
460 nm. Faux.
Dans la molécule A, quatre doubles liaisons sont conjuguées au lieu de
trois dans la molécule B. Le maximum d'absorption de la molécule B sera
situé à une valeur inférieure à 395 nm.
Soit S0 une solution aqueuse de la molécule A de concentration molaire c0. Par dilution, on prépare une solution S1 : 10 mL de solution S0
sont introduits dans une fiole jaugée de 100 mL et la fiole jaugée est
complétée avec de l’eau distillée jusqu’au trait de jauge. Dans les
conditions opératoires utilisées pour la courbe d’étalonnage,
l’absorbance de S1 est mesurée : AS1 = 0,60.
d) La concentration de la solution S0 est égale à 2,7.10-4 mol.L-1. Vrai.
Le facteur de dilution est égal à 10. S0 est donc 10 fois plus concentrée que S1 soit c0 = 2,7 10-4 mol / L.
Exercice
3. Quatre spectres de transmittance d’espèces chimiques en phase gazeuse sont représentés sur les documents ci-dessous.
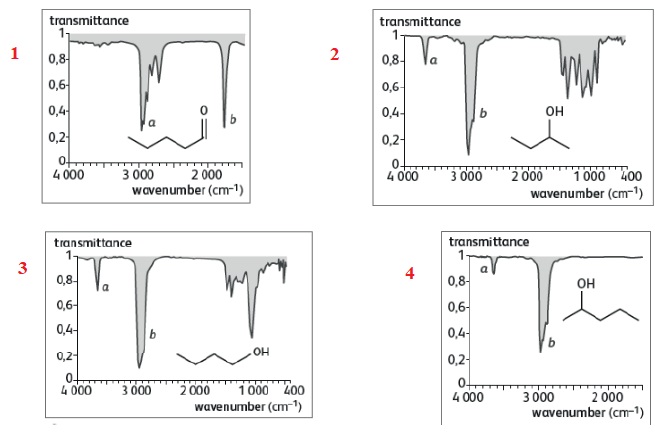
a) Sur le document n°2 , la bande b a une absorption plus élevée que la bande a. Vrai.
Bande b : 3000 cm-1 soit 1 / 3000 = 3,3 10-4 cm.
Bande a : 3600 cm-1 soit 1 / 3600 = 2,7 10-4 cm.
b) Tous ces spectres sont réalisés à des longueurs d’onde appartenant au domaine des IR. Vrai.
c) La valeur approchée du nombre d’onde (wavenumber) de l’absorption relative à la liaison C = O vaut 3000 cm-1. Faux.
1700 cm-1.
d) Parmi les espèces chimiques, il y a deux isomères. Vrai.
Les molécules des spectres 2 et 3 sont isomères.
Exercice 4.
Le terpinéol est une molécule naturelle extraite de l’essence
naturelle de pin. Il est utilisé en parfumerie pour son agréable odeur
de lilas. La formule topologique du terpinéol est donnée ci-après.
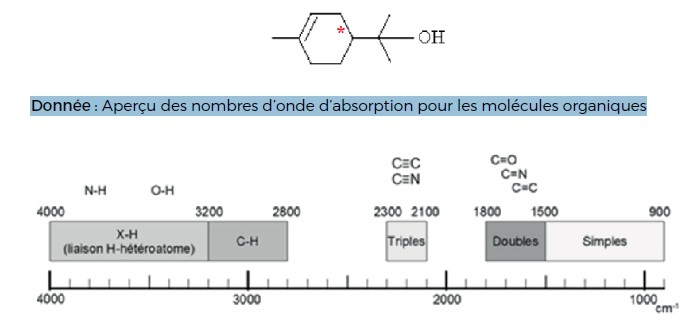
a) La formule brute du terpinéol est C10H19O. Faux.
C10H18O
b) Le terpinéol est un acide aminé. Faux.
Il ne possède ni de fonction acide carboxylique, ni de fonction amine.
c) Le terpinéol possède un atome de carbone asymétrique. Vrai.
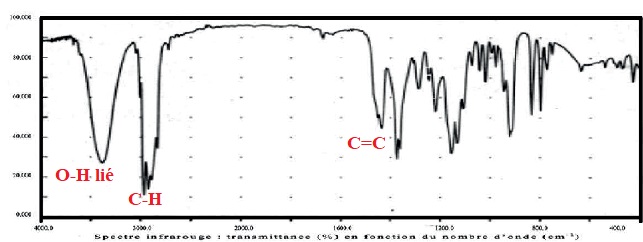
d) Le spectre ci-dessous est compatible avec la formule du terpinéol. Vrai.
Exercice 5.
Le spectre de RMN d’une molécule de formule brute C3H5BrO est représenté.
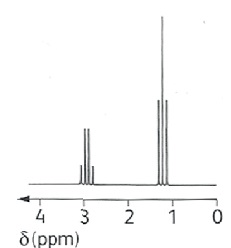
a) Il y a sept groupes d’atomes d’hydrogène équivalents dans la molécule. Faux.
b) Le signal situé à 2,93 ppm est un quintuplet. Faux.
Quadruplet.
c) Les protons du signal situés à 1,24 ppm sont voisins de deux protons. Vrai.
d) La formule semi-développée de la molécule étudiée est CH3-CO-CH2-Br. Faux.
Le spectre RMN d'une telle molécule présenterait 2 singulets.
|
|
Exercice
6.
On cherche à identifier une molécule de formule brute C3H7Br dont le spectre de RMN est représenté cidessous. Le nombre indiqué au-dessus de chaque signal indique un nombre de protons.
Donnée : l’électronégativité du brome est supérieure à celle du carbone.
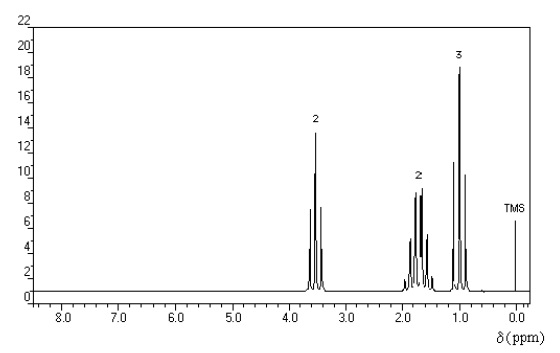
a) Il y a trois groupes de protons équivalents. Vrai.
b) Le signal de déplacement chimique � d= 1,7 ppm correspond à des protons possédant six voisins. Faux.
6 pics soit 5 protons voisins.
c) Les protons situés sur le carbone voisin de l’atome de brome génèrent le signal de déplacement chimique � d= 3,5 ppm. Vrai.
d) Cette molécule est du 1-bromobutane. Faux.
Br-CH2-CH2-CH2-CH3, donne 4 signaux en RMN et sa formule brute est C4H9Br.
Exercice 7.
Les ions iodure I- réagissent avec les ions peroxodisulfate S2O82-. L’équation associée à la réaction s’écrit :
2 I-(aq)+S2O82-(aq)→I2(aq)+2 S042-(aq).
A t = 0, on réalise un mélange réactionnel S à partir d’une quantité de matière d’ions iodure n 1 = 5,0.10 -3 mol et d’un volume V2 = 10,0 mL de solution aqueuse de peroxodisulfate de sodium de concentration molaire en soluté apporté c2 = 5,0.10-3 mol.L-1.
La courbe ci-dessous représente l’évolution de l’avancement x en fonction du temps t.
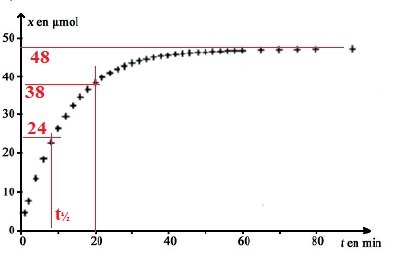
a) Si la température augmente, la valeur de l’avancement maximal xmax sera plus importante. Faux.
L'équilibre est plus rapidement atteint mais sa composition reste inchangée.
b) Pour obtenir, à l’instant t = 10 min, un avancement x égal à 0,015 mol, on peut utiliser un catalyseur. Faux.
0,015 mol > 50 µmol.
c) Le temps de demi-réaction est égal à environ 5 minutes. Faux. ( environ 8 min)
d) A l’instant t = 20 minutes, la quantité de matière restante en ions peroxodisulfate est égale à environ 12 μmol.). Vrai.
Quantité de matière de diiode formé : x20 = 38 µmol.
Quantité de matière d'ion peroxodisulfate consommée : 38 µmol.
Quantité de matière initiale d'ion peroxodisulfate V2c2 = 50 µmol.
Quantité de matière d'ion peroxodisulfate restante : 12 µmol.
Exercice 8.
Les formules topologiques de deux molécules A et B sont données ci-dessous.
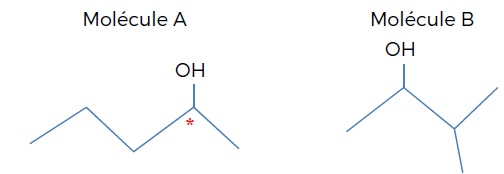
a) La formule brute de la molécule A est : C5H11O. Faux.
C5H12O.
b) La molécule B est un isomère de la molécule A. Vrai.
c) La molécule A ne possède pas de diastéréoisomères. Vrai.
La présence d'un atome de carbone asymétrique conduit à l'existence de deux énantiomères.
d) La molécule A n’a que deux conformères. Faux.
On passe d'un conformère à un autre par rotation autour d'une liaison simple.
|
|
Exercice 9.
Le rouge de méthyle est un indicateur coloré. Sa teinte est rouge en milieu très acide et jaune en milieu basique.
On a représenté ci-dessous la formule topologique des deux formes acide
et basique présentes dans une solution aqueuse de cet indicateur coloré.
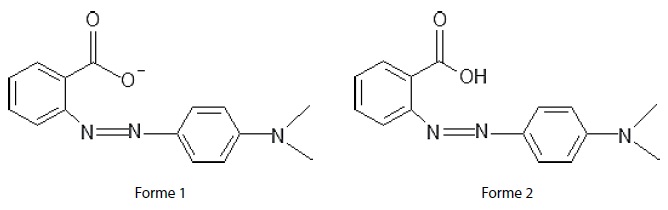
Donnée : constante d’acidité du couple (forme 2 / forme 1) : Ka. = 10-5,2.
a) La masse molaire ionique de la forme 1 est égale à 268 g.mol-1. Vrai.
M[C15H14N3O2- ]=15 x 12 + 14 +3 x14 +16 x2 =268 g / mol.
b) Lorsque la forme 2 est prépondérante, la solution a une teinte jaune. Faux.
La forme 2 prédomine à pH < pKa ( 5,2). Sa teinte est rouge.
c) La forme 1 absorbe essentiellement dans le bleu. Vrai.
La forme 1 est jaune ; la couleur complémentaire du jaune est le bleu.
d ) A pH = 4,2, (forme 2) / (forme 1) = 0,1. Faux.
pH = pKa + log (forme 1) / (forme 2) ;
log (forme 1) / (forme 2) =4,2-5,2 = -1 ; (forme 1) / (forme 2) =0,1.
(forme 2) / (forme 1) =10.
Exercice 10.
On désire doser l’acide ascorbique C6H8O6
contenu dans un comprimé de vitamine C. On écrase un demi comprimé de
vitamine C dans un mortier. On introduit la poudre dans une fiole
jaugée de 100 mL, on complète avec de l’eau distillée, on obtient la
solution S.
On prélève 10 mL de la solution S que l’on dose avec une solution d’hydroxyde de potassium (K+(aq) + HO_(aq)) de concentration molaire c = 1,0.10-2 mol.L-1. La courbe de ce titrage pH-métrique est représentée ci-dessous, où Vb est le volume d’hydroxyde de potassium versé.
Donnée :
couples acide/base intervenant au cours du dosage : C6H8O6(aq) / C6H7O6-(aq) et H2O (l) / HO-(aq) ;
M (C6H8O6) = 176 g.mol-1.
a) La valeur du pKa du couple auquel appartient l’acide ascorbique est voisine de 4. Vrai.
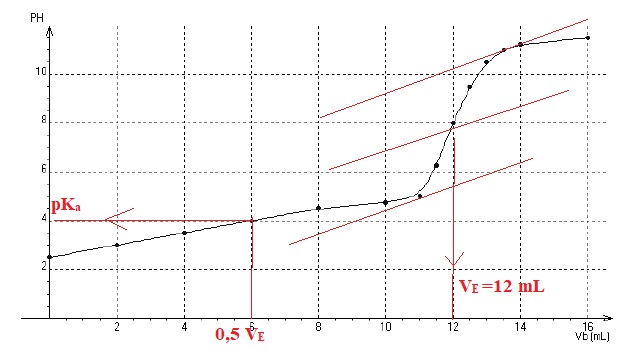
b) L’acide ascorbique est un acide fort. Faux.
Le pKa de l'acide ascorbique est supérieur à zéro, c'est un acide faible.
c) Un comprimé contient plus de 250 mg de vitamine C. Vrai.
A l'équivalence : CA = CbVE / Va = 0,010 x12 / 10 = 0,012 mol / L.
Soit pour un comprimé 0,0024 mol dissout dans 0,1 L.
Quantité de matière d'acide ascorbique dans un comprimé : 0,0024 mol soit 0,0024 x176 = 0,422 g.
Il existe quatre stéréoisomères de configuration a, b, c, et d de l’acide ascorbique dont l’un est la vitamine C.
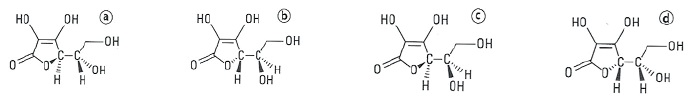
d) Parmi les quatre stéréoisomères de configuration de l’acide ascorbique a et c sont diastéréoisomères. Vrai.
Seul l'un des atomes de carbone asymétrique a changé de configuration.
Exercice 11.
La concentration molaire en ions chlorure Cl- peut être
déterminée à l’aide d’un dosage conductimétrique. Un volume de la
solution à doser est prélevé avec une pipette jaugée. Lors de l’ajout
d’une solution de nitrate d’argent (Ag+(aq)+NO3-(aq)) de concentration connue, la conductivité du mélange est mesurée.
La réaction support de cette transformation chimique est : Ag+(aq) + Cl-(aq) --> AgCl(s).
L’évolution de la conductivité en ffonction du volume de solution de nitrate d’argent introduit est présentée ci-dessous.
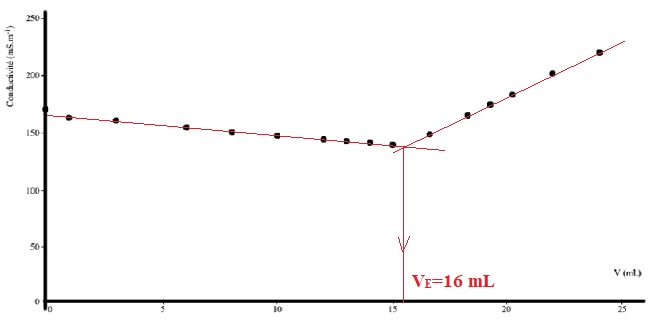
a)
Avant le volume équivalent, l’une des raisons expliquant la diminution
de la conductivité du mélange est la formation du précipité de chlorure
d’argent AgCl(s). Vrai.
L'ion argent est en défaut. Du point de vue de la conductivité, tout se
passe comme si on remplaçait l'ion chlorure par l'ion nitrate de
conductivité molaire ionique moindre.
b) Le volume équivalent de ce dosage est environ égal à 16 mL. Vrai.
c) La conductivité du mélange croît après le volume équivalent car il y a de plus en plus d’ions chlorure dans le mélange. Faux.
La conductivité croît car on ajoute des ions argent et nitrate.
d) Un dosage pH-métrique peut être utilisé pour déterminer la concentration molaire en ions chlorure. Faux.
Exercice 12.
Les esters sont responsables du goût et de l'odeur agréable de nombreux
fruits et fleurs ainsi que de parfums artificiels. Ainsi l’éthanoate de
benzyle a l’odeur "fleurie" du jasmin.
L’éthanoate de benzyle peut-être synthétisé par la réaction suivante :
C6H5-CH2OH(l) + CH3-COOH(l) =H2O(l) + CH3-COO-CH2-C6H5 (l)
Protocole pour la synthèse de l’éthanoate de benzyle
Introduire dans un ballon, avec précaution, 18,0 g d'acide éthanoïque CH3-COOH, 10,8 g d'alcool benzylique C6H5-CH2OH, 3 gouttes d'acide sulfurique concentré et quelques grains de pierre ponce.
Chauffer le mélange à ébullition douce pendant 30 minutes environ avec le montage à reflux .
Laisser refroidir le mélange.
Introduire 50 mL environ d'une solution saturée de chlorure de sodium et mélanger.
Transvaser ce mélange dans une ampoule à décanter. Agiter.
Laisser décanter les deux phases.
Après avoir séparé les phases, introduire dans la phase organique une pointe de spatule de sulfate de magnésium : un desséchant.
Après filtration, peser la phase organique.
a) L’utilisation du montage à reflux permet de dire que cette réaction n’est pas totale. Faux.
La réaction est lente.
b) La phase organique dans l’ampoule à décanter se trouve au-dessus. Vrai.
La phase la plus dense ( eau salée d = 1,5) se trouve dans la partie inférieure.
c) L’eau salée facilite la séparation entre les deux phases. Vrai.
La solubilité de l'ester dans l'eau salée est nulle.
Lors d’un essai, la masse obtenue d’éthanoate de benzyle est égale à 7,5 g.
d) Le rendement de cette transformation chimique est égal à 50%. Vrai.
Quantités de matière : acide éthanoïque : 18 / 60 = 0,3 mol ( en excès) ; alcool benzilique : 10,8 / 108 =0,10 mol.
Quantité de matière théorique d'ester 0,10 mol soit 0,10 x150 = 15 g.
Rendement = masse expérimentale / masse théorique = 0,5.
Exercice 13.
On s’intéresse aux mécanismes de réaction.
a) Une flèche courbe correspond au déplacement d’un doublet d’électrons. Vrai.
b) L’ion hydrogène est un site donneur de doublet d’électrons. Faux.
Une réaction de substitution peut être modélisée par l’équation suivante :
HO- + CH3Br --> CH3-OH + Br-
Donnée : l’électronégativité du brome est supérieure à celle du carbone.
c) Le mécanisme suivant permet d’expliquer cette réaction de substitution. Faux.
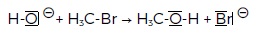
d) L’atome de carbone lié au brome est un site donneur de doublet d’électrons. Faux.
Exercice 14.
L’acide acétylsalicylique est le principe actif de l’aspirine. La
synthèse de l’acide acétylsalicylique peut être réalisée au laboratoire
à partir d’acide salicylique et d’anhydride éthanoïque. La réaction de
synthèse a pour équation :
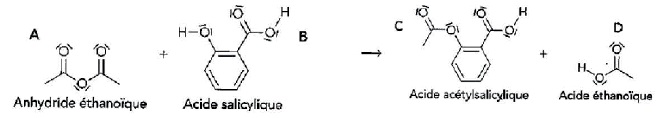
Donnée : l’électronégativité de l’oxygène est supérieure à celle du carbone.
a) Le bilan de cette synthèse est une réaction de substitution. Vrai.
b) L’atome d’oxygène, désigné par la flèche ci-dessous, est un site accepteur de doublet d’électrons. Faux.
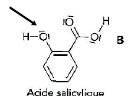
En réalité la réaction de synthèse est un mécanisme qui se fait en plusieurs étapes dont la première étape a pour équation :
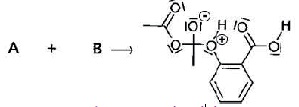
c) La réaction de la première étape du mécanisme est une réaction d’addition. Vrai.
d) La seconde étape du mécanisme de la réaction de synthèse est une réaction acido-basique. Vrai.
Exercice 15.
Lorsque le raisin est mûr, la concentration en saccharose (sucre) atteint ou dépasse 6,00.10-1 mol par litre de jus de raisin. Les vendanges peuvent commencer, les grappes de raisin sont à maturité optimale.
Le maitre de chais sait qu’il faut 18,0 g de sucre par litre de jus pour obtenir un degré d’alcool.
Il utilise la réfractométrie, technique basée sur la mesure de l’indice
de réfraction n d’un milieu transparent pour trouver la quantité de
sucre dans ses jus de raisin et en déduire le degré d’alcool de son vin.
Dans un premier temps, il mesure l’indice de réfraction ni de différentes solutions Si de saccharose, de concentrations massiques Cmi connues,
en les plaçant successivement dans une cuve traversée par un rayon
lumineux . Ses mesures sont rassemblées et permettent de tracer le
graphe ni = f (Cmi).
Dans un second temps, il mesure l’indice de réfraction de deux
échantillons A et B de jus de raisin vendangé quelque temps auparavant.
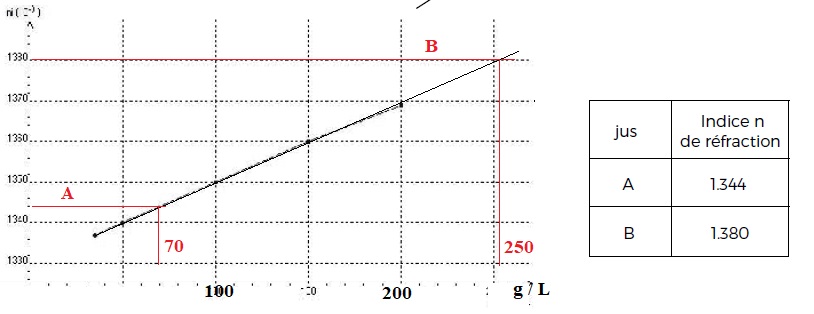
Données : masse molaire du saccharose : 342 g.mol-1.
L’indice de réfraction n d’un milieu transparent est donné par la
relation n = c / v où c est la célérité de la lumière dans le vide et v
la célérité de la lumière dans le milieu considéré.
a) La réfraction est le changement de direction d’un rayon lumineux
lorsqu’il traverse la surface de séparation de deux milieux
transparents d’indice différent. Vrai.
b) Le jus B est plus sucré que le jus A. Vrai.
c) Le raisin du jus A est mûr. Faux.
70 /342 =0,20 mol / L, valeur inférieure à 0,6 mol / L.
d) Le jus B est un jus qui a un degré d’alcool supérieur à 12,5°. Vrai.
250 / 18 =13,9°.
Exercice 16.
Le
territoire du Québec possède de nombreux lacs appelés « lacs acides »
dont le pH est inférieur ou égal à 5,0. Cette acidité d’origine
naturelle ou humaine est survenue au cours des cent dernières années.
Touchés par les pluies acides, émises par les grosses industries, les
résidents du lac des
Hauteurs doivent, pour contrer l'effet de l'acidité, épandre de la
chaux sur leur terrain et planter des feuillus. La réduction des
émissions polluantes représente
vraisemblablement la meilleure solution à long terme pour éliminer le
problème des pluies acides. Toutefois, en attendant ces réductions, il
faut parfois recourir à des solutions temporaires : le chaulage
représente l'une de ces rares alternatives.
Au Québec, le chaulage a été évalué expérimentalement par le ministère
de l’environnement et de la faune. Une vingtaine de lacs,
principalement dans la région des trois rivières sont maintenant
chaulés. Cette technique consiste à augmenter le pH du lac en y versant
une base solide telle que le carbonate de calcium. La réaction de
chaulage considérée comme totale s’écrit :
Ca2+(aq) + CO32-(aq) + 2 H3O+→ CO2(aq) + Ca2+(aq) + 3 H2O(l)
Des demandes d’aides financières sont réclamées car le coût de la tonne de carbonate de calcium CaCO3(s) se situe aux environs de 1200 euros et ces lacs ont des volumes pouvant atteindre 500 millions de m3.
De plus, une fois réalisé, le chaulage du plan d'eau permet un retour à
la normale pendant seulement une quinzaine d’années, il faut ensuite
renouveler l’opération.
D’après le ministère du développement durable de l’environnement et des parcs.
Données : masse molaire du carbonate de calcium CaCO3 = 100 g.mol-1 ;
couples acide/base intervenant au cours du chaulage : CO2, H2O / HC03-(aq) / C032-(aq) ;
V = 500 millions de m3.
a) Pour être qualifié d’acide, un lac de volume V doit contenir au minimum 5,0 millions de moles d’ions oxonium H30+. Vrai.
[H3O+ ] > 10-5 mol / L.
10-5 x500 x 109 = 5 106 mol.
b) L’ion carbonate C032-(aq) est une espèce amphotère. Faux.
HC03-(aq) est amphotère.
c) Pour obtenir un pH
final égal à 6,0 dans l’eau d’un lac acide de volume V, de pH initial
égal à 5,0, il faut y déverser environ 23 tonnes de carbonate de
calcium. Faux.
[H3O+ ] initial = 5 106 mol ; [H3O+ ] final = 5 105 mol ; variation : 4,5 106 mol.
Quantité de matière de carbonate de calcium : 0,5 x4,5 106 = 2,25 106 mol.
Masse correspondante : 100 x 2,25 106 = 2,25 108 g = 2,25 105 kg = 225 tonnes.
d) Le coût du chaulage pour augmenter d’une unité le pH d’un lac de volume V dépasse les 200 000 euros. Vrai.
1200 x 225 = 270 000 €.
|
|