Chimie,
concours aide technique 2002.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
I. Préparation d'une solution.
On souhaite préparer 1 L de solution aqueuse de chlorure d'ammonium NH4Cl ( solution A) et 1 L de solution aqueuse d'ammoniac NH3 ( solution B) de même concentration 0,1 mol / L.
1. Quelle masse m de chlorure d'ammonium anhydre faut-il peser ?
Quantité de matière de chlorure d'ammonium : n = 0,1 mol.
M(NH4Cl) = 14 +4 +35,5 =53,5 g / mol.
m = 0,1 x53,5 = 5,35 g.
2. Pour préparer la
solution B, on utilise une solution mère de concentration C = 1 mol /
L. Calculer le volume de solution mère à prélever pour obtenir 200 mL
de solution B.
Facteur de dilution F = 1 /0,1 = 10.
Volume de solution mère à prélever : 200 / 10 = 20 mL.
3. Indiquer les produits et la verrerie nécessaires à la préparation de B.
Verser un peu de solution mère ( NH3) dans un becher de 100 mL.
Prélever 20,0 mL de cette solution à l'aide d'une pipette jaugée.
Verser ce prélevement dans une fiole jaugée de 200 mL contenant un peu d'eau distillée.
Compléter jusqu'au trait de jauge avec de l'eau distillée.
Boucher et agiter pour rendre homogène.
4. Quelles sont les précautions à prendre lors de cette préparation ?
Port de blouse, gant et lunettes de protection.
II. Dosage d'un vinaigre.
L'étiquette d'une bouteille de vinaigre porte l'indication : 6 degrés.
Le degré correspond à la ùmasse d'acide éthanoïque pur dans 100 g de vinaigre.
On souhaite déterminer la concentration molaire en acide éthanoïque C de ce vinaigre.
1. On prépare une solution S de volume V1 = 100 mL et de concentration en acide éthanoïque C1 = 0,01 C.
a. Quel volume de vinaigre fautil prélever ?
Facteur de dilution : 1 / 0,01 = 100.
Volume à prélever : V1 / 100 = 1,0 mL.
2. On prélève v1 = 10 mL de solution S que l'on dose avec une solution d'hydroxyde de sodium de concentration CB = 0,010 mol/ L. L'équivalence est obtenue pour VBE = 10,8 mL.
a. Faire un schéma du dispositif.
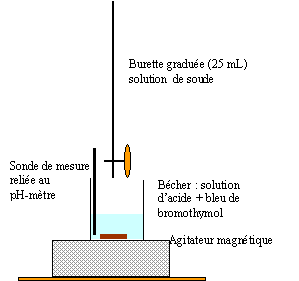
b.
Les indicateurs disponibles sont la phénolphtaléine ( zone de virage
8,2 - 9,8) et l'hélianthine ( zone de virage ( 3,2 - 4,4). Indiquer le
choix de l'indicateur coloré. Justifier.
A l'équivalence la solution contient une base faible, l'ion éthanoate CH3COO-, le pH est donc supérieur à 7.
Le pH du point équivalent doit appartenir à la zone de virage de l'indicateur coloré. On choisit la phénolphtaléine.
c. Calculer C1 puis C.
A l'équivalence C1 = CB VBE / v1 = 0,010 x10,8 / 10 = 0,0108 mol/ L.
C = 100 C1 = 1,08 mol / L.
d. La densité du vinaigre est égale à 1. Calculer le degré du vinaigre et le comparer avec l'indication de l'étiquette.
M(CH3COOH) =12 x2 +4 +2 x16 = 60 g / mol.
masse d'acide éthanoïque dans 1 L de vinaigre : 60 x1,08 =64,8 g.
Soit 6,48 g d'acide éthanoïque dans 100 g de vinaigre ( degé : 6,48).
Eczrt relatif ( 6,48 -6) / 6 = 0,08 ( 8 %).
A 8% près, les résultats concordent.
|
|
|
.
|
|
|
|
Identification de composés organiques.
L'ion dichromate appartient au couple Cr2O72- / Cr3+.
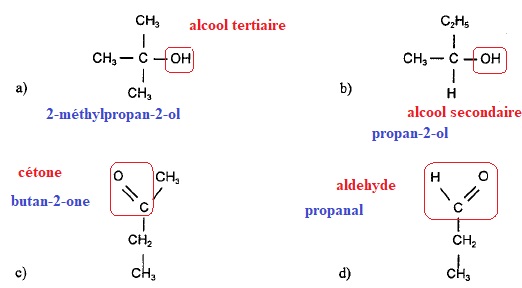
On dispose de 4 flacons contenant chacun l'un des 4 composés organiques suivants :
1. Nommer chaque composé et préciser la fonction qui le caractérise.
2. Pour vérifier le
contenu de chaque flacon, on les numérote de 1 à 4 et on effectue une
série d'essais qui se révèlent positif ou négatif.
N° du flacon
|
dichromate de potassium en milieu acide
|
Dinitro-2, 4 -phénylhydrazine ( DNPH)
|
Liqueur de Felhing
|
1
|
-
|
-
|
-
|
2
|
+
|
+
|
+
|
3
|
-
|
+
|
-
|
4
|
+
|
-
|
-
|
Préciser le contenu de chaque flacon en justifiant.
1 : tests négatifs, alcool tertiaire a.
2. tests positifs, aldehyde d.
3 : un seul test positif ( la DNPH met en évidence un groupe
carbonyle), test négatif avec la liqueur de Fehling. Donc cétone
c.
4. un seul test positif, oxydation de l'alcool secondaire b.
|
|
|