La
chimie et le sport, Capes physique chimie 2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
Des
matériaux innovants au service de la performance.
Le
Gore-Tex est une membrane imperméable à l'eau liquide mais laissant
passer la vapeur d'eau issue de la transpiration. Il s'agit du
polytétrafluoroéthylène (PTFE) étiré après chauffage. Ce procédé permet
la création d'une surface microporeuse comprenant plus d'un milliard de
pores par cm2.
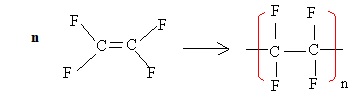
1. Ecrire
l'équation chimique de la formation du PTFE à partir du
tétrafluoroéthène et donner le motif de ce polymère.
2. Evaluer l'ordre de grandeur du
diamètre des pores, puis expliquer les propriétées enoncées
précédemment.
Le Gore-Tex est une fine membrane
constituée de milliard de trous de diamètre 0,2 µm.
Dimension d'une goutte d'eau liquide : ~ 4 mm soit 20 000 fois plus
grand qu'un trou. Ces molécules d'eau liquide étant liées entre elles,
elles ne peuvent pas passer dans les trous.
Les molécules de la vapeur d'eau issues de la transpiration, étant
dispersées et désordonnées, peuvent passer par les trous.
3. Pour illustrer le principe des synthèses
écoresponsables, un professeur choisit le
procédé initial de fabrication du PTFE utilisant des solvants
chlorofluorocarbons, avant d'être remplacés par l'eau, puis du CO2
supercritique comme solvant.
Proposer une problématique et formuler un exemple de réponse à celle-ci.
Problématique
: les chercheurs doivent trouver des solutions nouvelles pour
créer une chimie plus propre et plus sûre tout en restant
compétitive.
Comment
définir cette nouvelle chimie ?
- Utiliser au maximum la matière première et générer le moins possible
de sous-produits, ces derniers devant être recyclables.
- Privilégier les matières premières renouvelables aux matières
premières fossiles.
- Remplacer les solvants toxiques et dangereux par des solvants propres
tel que le CO2 supercritique ou l'eau sous pression.
- Meilleure utilisation de l'énergie en terme de rendement et d'conomie
de sources et de rejets.
- Les déchets et effluents doivent constituer une matière première
recyclable.
- Rendre inerte, non réactive, la quantité minimale de déchets restants.
Afin de comprendre la structure du PTFE, les propriétés du
perfluorobutane ( C4F10) et du butane sont
comparées.
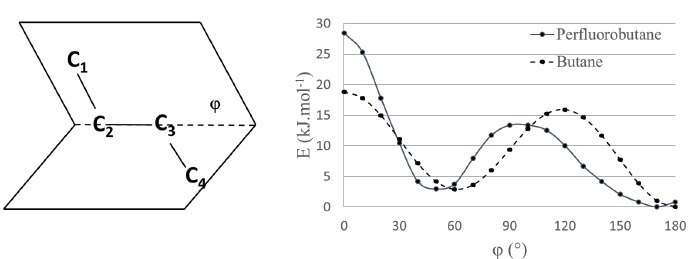
A gauche : représentation de l'angle
dièdre f ; à
droite : évolution de l'énergie potentielle du perfluorobutane et
du butane en fonction de l'angle dièdre.
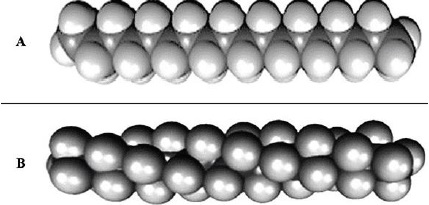
A. Conformation en "zigzag" plane d'une chaine de polyéthylène ; B
conformation en hélice du PTFE.
.
4. Représenter en projection de
Newmann selon l'axe de la liaison C2-C3, les
conformations associées à tous les minima et à tous les maxima
d'énergie potentielle du butane. Expliquer qualitativement les
différences d'énergie observées.
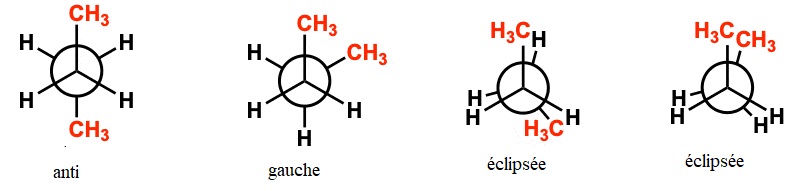 La
conformation anti est la plus stable, les groupes méthyles sont les
plus éloignés l'un de l'autre. L'encombrement stérique est minimum.
La
conformation anti est la plus stable, les groupes méthyles sont les
plus éloignés l'un de l'autre. L'encombrement stérique est minimum.
La
conformation éclipsée est la moins stable, les groupes méthyles sont
très proches l'un de l'autre. L'encombrement stérique est maximum.
5. Comparer la différence de stabilité du
perfluorobutane et du butane pour l'angle dièdre f = 0.
Le perfluorobutane est moins stable que le butane l'angle dièdre f = 0.
Les atomes de fluor sont plus gros que les atomes d'hydrogène.
La densité électronique, supérieure pour les atomes de fluor, entraîne
une répulsion plus importante que celle des atomes d'hydrogène dans le
butane.
6. Justifier les conformations
adoptées pour les 2 chaines de polymères.
Polyéthylène
: suite de butane accrochés les uns aux autres, les groupes CH3
étant templacés par la suite de la macromolécule. Le PE est uns suite
de conformations décalées ( la plus stable). La chaine du PE étirée est
donc plane.
PTFE : tous les groupements de deux
atomes de carbone adjacents ont une conformation trans ( rotation de
13° de chaque atome de carbone dans la chaine. La structure est donc
hélicoïdale.
Optimiser les apports énergétiques.
Les cellules du corps humain utilisent le glucose pour produire l'ATP.
1. Du saccharose au glucose, le carburant du sportif.
La molécule de saccharose est hydrolysée en milieu acide ( dans
l'estomac) mais aussi par voie enzymatique ( intestin grèle )par une
enzyme, l'invertase. On obtient le D-glucose et le D-fructose.
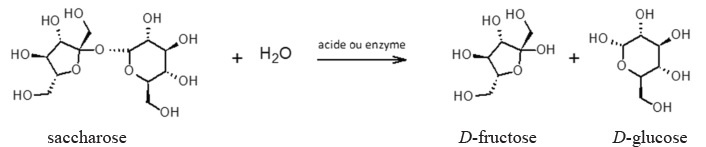 Cette hydrolyse s'effectue en deux étapes :
Cette hydrolyse s'effectue en deux étapes :
Etape 1 : équilibre de formation du complexe enzyme notée E / substrat noté S.
Etape 2 : dissociation irréversible du complexe ES.
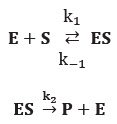
Conservation de matière de E : [E]totale = [E] + [ES].
On peut appliquer l'approximation de l'état stationnaire à l'espèce ES.
7. a Montrer que la vitesse de formation du produit P peut s'écrire :
v = vmax / (1+Km / [S]).
v = k2[ES].
k1[E][S] -(k2+k-1)[ES] = 0.
k1([E]totale - [ES])[S] -(k2+k-1)[ES] = 0.
[ES]=k1[E]totale [S] / (k2+k-1+k1[S]) .
v = k2k1[E]totale [S] / (k2+k-1+k1[S]) .
v = k2k1[E]totale / ((k2+k-1)/[S]+k1) .
v = k2[E]totale / ((k2+k-1) / ([S] k1)+1).
vmax = k2[E]totale ; Km = (k2+k-1) / k1.
v0 = vmax / (1+Km / [S]0).
b. Une linéarisation décrit l'évolution de 1 / v0 en fonction de 1 / [S]0.
Exprimer la pente et l'ordonnée de cette linéarisation en fonction de Km et vmax. Déterminer leurs valeurs.
1/v0 = 1 /vmax +1+Km / [S]0.
Pente : Km / vmax ; ordonnée à l'origine : 1 / /vmax.
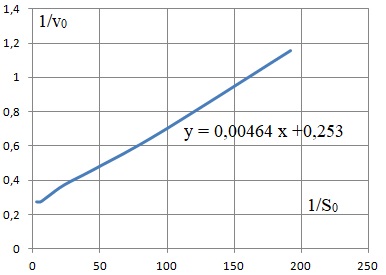
vmax =1 /0,253 ~ 3,9 mol L-1min-1.
Km = 3,9 x0,00464 ~0,018 mol L1.
8. Expliquer pourquoi les valeurs de v0 pour les essais 1 et 2 sont identiques.
[S]0 est en large excès.
|
|
....
|
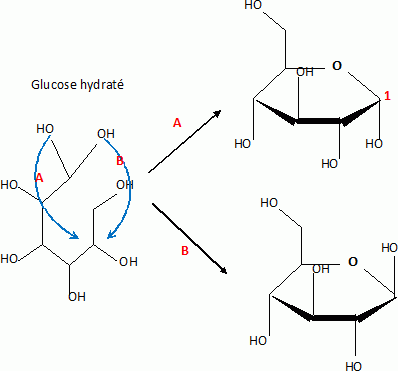
2. Le glucose.
A 25°C, en solution aqueuse, le D-glucose est présent sous
différentes formes en équilibre, une forme ouverte linéaire, très
minoritaire ( 0, 002 %) et deux formes cycliques.
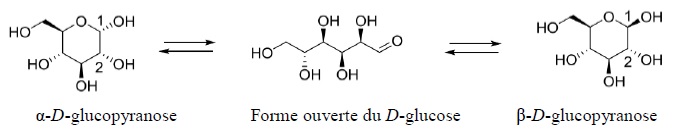
9. Déterminer en justifiant la configuration absolue des atomes decarbone notés 1 et 2.
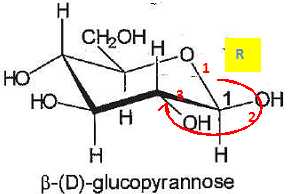
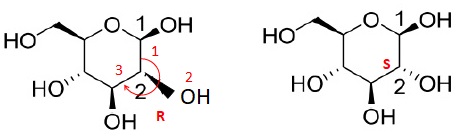
10. Nommer, en justifiant, la relation de stéréoisomérie existant entre la molécule d'a-D-glucopyranose et celle du ß-D-glucopyranose.
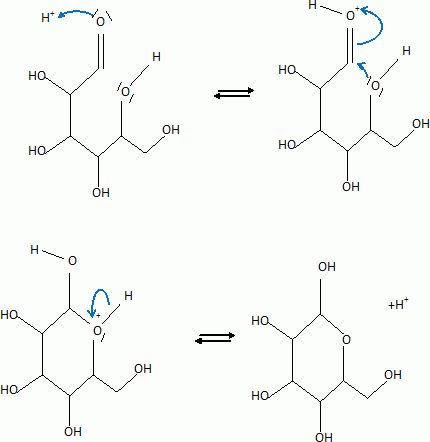
L'atome de carbone du groupe carbonyle ( aldehyde) est
trigonal plan. L'attaque de H+ se
fait indifféremment d'un côté ou de
l'autre du plan.
Dans la forme cyclique du glucose un nouvel atome de
carbone est créé : sa configuration est R ou S
suivant le côté de l'attaque par
H+.
Le carbone 1 est asymétrique : les deux anomères sont énantiomères.
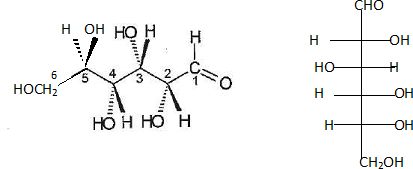
11. Représenter la forme ouverte de la molécule de D-glucose en utilisant la représentation de Fisher.
Afin de déterminer les proportions respectives des formes a et ß du G-glucose, on effectue un dosage par polarimétrie. Une solution aqueuse de a-D-glucose
est préparée par dissolution de 2,00 g de cristaux purs dans 5,0 mL
d'eau distillée. La cellule de mesure, de longueur L = 10,0 cm est
remplie et le pouboir rotatoire q de la solution est mesuré à la longueur d'onde l
= 589,3 nm. Au bout de 4 heures, le pouvoir rotatoire est égal à 21,1°
et n'évolue plus. Il en est de même en partant d'une solution de
ß-D-glucose préparée dans les mêmes conditions de concentration.
12. Enoncer
la loi de Biot reliant le pouvoir rotatoire aux cencenntrations en
masse des espèces optiquement actives. Déterminer la composition du
mélange à l'équilibre.
Loi
de Biot traduit la proportionnalité entre le pouvoir rotatoire d'un
milieu et les concentrations en produits optiquement actifs
(dextrogyres ou lévogyres) :
a (°) angle de rotation du plan de vibration des ondes lumineuses ; [a] : pouvoir rotatoire spécifique ( ° m2 kg-1 ) ; Cm: concentration ( kg m-3 ) ;
L : longueur (m) de cuve.
Ou encore : pouvoir rotatoire spécifique ( ° mL g-1 dm-1 ) ; Cm: concentration ( g mL-1 ) ; L : longueur (dm) de cuve.
Pouvoir rotatoire spécifique ( ° mL g-1 dm-1 ) : a-D-glucopyranose : [aa]25°CD =+112 ;
b-D-glucopyranose : [aß]25°CD =+18,7 .
a0 =( [aa]25°CD x +[aß]25°CD y ) L.
x : concentration massique a-D-glucopyranose ; y : concentration massique b-D-glucopyranose.
x +y = 2 / 5 = 0,4 g / mL.
21,1 = (112 x +18,7 (0,4-x).
21,1 = 93,3 x +7,48.
x = 0,146 ~0,15 g/ mL et y = 0,25 g / mL.
13. Ecrire le mécanisme expliquant la formation d'un composé cyclique à partir de la forme linéaire ( catalyse acide).
|
|