Dosage
du dioxygène par la méthode de Winkler. Concours CAPLP
2020.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
Diagramme
potentiel-pH de l'eau.
1. Définir un
oxydant.
Un oxydant est une espèce chimique, ion ou molécule, susceptible
de céder un ou plusieurs électrons.
2. Quel est le
couple redox dont le potentiel standard est fixé à zéro.
H+aq / H2(g).
3. Quels sont les
nombres d'oxydation des éléments hydrogène et oxygène dans les espèces H+,
H3O+ et H2O ? Que peut-on en conclure
quand aux éventuelles réactions d'oxydo-réduction entre ces
espèces ?
Le nombre doxydation de l'élément hydrogène est égal à + I dans ces
espèces et celui de l'élément oxygène est égal à -II dans ces espèces.
Il n'y a pas de réaction d'oxydo-réduction entre ces espèces.
4. Déterminer
l'équation de la frontière du couple H2O / H2(g)
dans un diagramme E=f(pH) établi à 25°C en prenant une pression
conventionnelle de 1 bar.
H2O +
e- =½
H2(g)
+HO-aq. DG°
= -FE°(H2O
/ H2(g)).
H+aq
+
e- =½
H2(g). DG°
= -FE°(
H+aq / H2(g))
=0.
H2O
= HO-aq +
H+aq. DG°
= -RT ln Ke .
-RT
ln Ke = -FE°(H2O
/ H2(g))
; E°(H2O
/ H2(g))=
-0,827 V.
E
=E°(H2O
/ H2(g))
+0,06 log([HO-aq] P½H2)).
E =-0,827 +0,06 log([
H+aq] / Ke).
E = -0,827+0,06log ( ([
H+aq]
) +0,06 x14 .
E = 0,06log ( ([
H+aq]
) = -0,06 pH.
Dosage de
Winkler
1ère étape
:On
place, dans un grand cristallisoir, destiné à récupérer l’excès de
produits introduits, un erlenmeyer de 250 mL rempli à ras bord de l’eau
à analyser. On introduit également un barreau magnétique.
On
ajoute 1,0 g de soude (ou hydroxyde de sodium) NaOH et 2 g de chlorure
de manganèse solide MnCl2(s).
On bouche alors rapidement l’erlenmeyer en veillant à ne pas y
emprisonner d’air, et on agite le mélange pendant 30 minutes environ.
5.
Quelles précautions sont à prendre pour manipuler les pastilles
d'hydroxyde de sodium ?
Port de blouse, gant et lunettes de protection.
6. A quoi servent les pastilles d'hydroxyde
de sodium ?
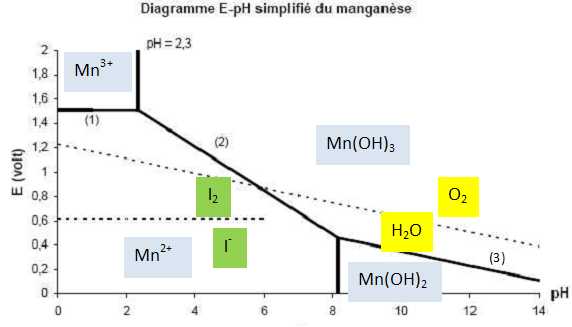
Mn2+ et O2 appartiennent
à des domaines disjoints uniquement en milieu basique. L'oxydation de Mn2+
par le dioxygène conduit à Mn(OH)3.
7. Pourquoi est-il nécessaire d'attendre 30
minutes ?
8. Ecrire les deux demi-équations
d'oxydo-réduction puis l'équation bilan de la réaction du dioxygène
dissous avec Mn(OH)2 (s). Identifier le précipité brun.
½O2 +H2O +2e-= 2HO- ; 2Mn2+ +6HO- =2Mn(OH)3 +2e-.
2Mn2+ +6HO- +½O2 +H2O +2e-=2Mn(OH)3 +2e-+ 2HO-.
2Mn2+ + ½O2 +4HO- +H2O ---> 2Mn(OH)3 (
solide brun). La transformation est lente, il faut donc attendre 30
minutes.
Seconde étape :
On
ouvre alors l’erlenmeyer, et on ajoute rapidement de l’acide sulfurique
concentré.
On ajoute alors 3 g de iodure de potassium KI(s).
Boucher, remettre sous agitation. Le précipité brun doit disparaître ;
il persist eun coloration jaune due au diiode.
9. Pourquoi
ajoute-t-on de l'acide sulfurique concentré ? Ecrire l'équation de la
réaction alors associée à l'hydroxyde de manganèse(III).
Ceci
a pour effet de rendre la solution acide et de dissoudre les hydroxydes
du manganèse.
Mn(OH)3(s)
+ 3 H+
aq= Mn3+aq
+ 3 H2O.
10. A-t-on besoin d'être à l'abri du
dioxygène de l'air après cette acidification ? Justifier.
Après
l'ajout, on peut laisser l'erlenmeyer ouvert, car il n'y a plus
d'oxydation possible par O2 dissout
en milieu acide.
11. Expliquer pourquoi en milieu
acide, les ions iodures I-aq peuvent réduire les ions Mn3+aq
en ion Mn2+aq en formant du diiode I2(aq). Ecrire
l'équation bilan de cette réaction chimique.
E°(Mn3+ / Mn2+) = 1,51 V ; E°(I2/I-)
=0,62 V.
Réaction spontanée entr l'oxydant le plus fort et le réducteur le plus
fort.
2I- = I2 +
2e-, oxydation
2Mn3+ +
2e- = 2Mn2+,
réduction.
2Mn3+ +
2I- = I2 +2Mn2+
.
|
...
|
....
|
Etape 3 :
On
pipette alors exactement V0 = 50,0 mL de
cette solution que l’on dose par une solution de thiosulfate de sodium
de concentration C
= 5,00.10-3 mol.L-1, en présence
d’empois d’amidon. Soit Ve le volume à
l’équivalence.
12. Faire un schéma annoté du
montage permettant le dosage.
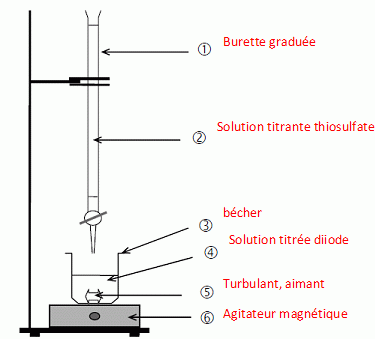
13.
Ecrire la
réaction de dosage du diiode par l'ion thiosulfate en milieu acide.
Calculer la constante de cet équilibre et justifier le caractère
quantitatif de cette réaction.
2S2O32-aq
+ I2aq = S4O62-aq
+ 2I-aq.
E1 =
E°[I2/I-) + 0,03 log ([I2] / [I-]2)
= 0,62 +0,03 log ([I2] / [I-]2)
E2 =
E°[S4O62-aq
/ S2O32-aq)
+ 0,06 log ([S4O62-aq]
/ [S2O32-aq]2)=
0,08 + 0,03 log ([S4O62-aq]2 /
[S2O32-aq]2)
A
l'équilibre E1 =E2 :
E°[S4O62-aq
/ S2O32-aq)-E°[I2/I-)
= 0,03 log [I- ]2[S4O62-aq]
/ ([I2] [S2O32-aq+]2)=
0,03 log K
log
K =(0,62-0,08)/0,03 = 18 ; K=
1018.
K est très grande, la réaction est donc quantitative.
14.
A quoi sert le thiodène ?
Indicateur
de fin de réaction : en présence de diiode, l'empois d'amidon donne une
couleur violette foncée.
15. Déterminer l'expression littérale du nombre de moles de I2 aq contenues dans le volume V0.
n(I2aq)
= ½n(S2O32-aq) = ½CVe.
16. En déduire l'expression littérale du nombre de moles d'ion Mn3+aq présents lors de la seconde étape et correspondant à V0.
1 O2 ---> 4 Mn(OH)3
--->
4 Mn3+--->2 I2.
n(Mn3+aq)
= 2n(I2aq)
=CVe.
17. En déduire l'expression du nombre de moles de Mn(OH)3 présents lors de la première étape, en correspondance avec V0.
n(Mn3+aq)
=n(Mn(OH)3)= 2n(I2aq)
=CVe.
18. Démontrer l'expression [O2] = [S2O32-aq] Ve / (4 V0).
n(O2) = 0,25 n(Mn3+aq)= 0,25CVe = [S2O32-aq] Ve / 4 dans V0.
[O2] = [S2O32-aq] Ve / (4 V0).
19. Donner l'expression littérale de la solubilité du dioxygène dans l'eau en g / L d'eau.
[O2] x M(O2) =M(O2) [S2O32-aq] Ve / (4 V0).
20. Un groupe d'élève a trouvé Ve = 10,8 mL. Comment qualifier l'eau dosée ?
[O2] = [S2O32-aq] Ve / (4 V0) = 5,00 10-3 x10,8 / (4 x50,0)=2,7 10-4 mol / L.
[O2] x M(O2) =2,7 10-4 x32 =8,64 10-3 g / L = 8,64 mg / L.
Cette valeur étant supérieure à 7, l'eau est d'excellente qualité.
|
|