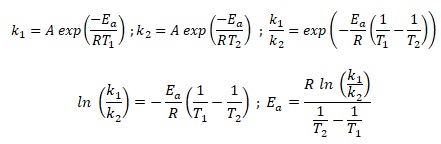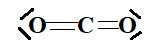Chimie
: eau de javel, décomposition pentaoxyde de diazote, pot
catalytique.
Concours externe TSPEI 2019.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
|
......
.....
|
Eau de Javel.
Synthèse.
On fait barboter du chlore dans une solution de soude ( Na+aq +HO-aq) selon la réaction (1) non équilibrée :
Cl2(g) +HO-aq --> ClO-aq +Cl-aq +H2O.
1. Donner les noms des espèces chimiques HO- et Cl-.
Ion hydroxyde et ion chlorure.
2. Ajuster les coefficients de l'équation.
Cl2(g) +2HO-aq --> ClO-aq +Cl-aq +H2O.
3. La constante d'équilibre de cette réaction est K = 7,7 1015. Commenter.
K étant très grande, la réaction est totale.
On fait barboter V = 50,0 L de dichlore dans une solution de soude à
1,0 mol / L et de volume 5,0 L. On suppose que le barbotage n'entraîne
pas de variation de volume.
4. Quelle masse de soude a-t-il fallu peser pour préparer la solution ?
M(soude) = 40 g / mol.
m = 5,0 x 40=200g dans 5 L.
5. Déterminer les
concentrations molaires de chaque espèce ionique en fin de réaction.
Volume molaire des gaz dans les conditions de l'expérience Vm = 25,0 L / mol.
Initialement : n(soude) = 5 mol ; n(dichlore) =50 /25 = 2,0 mol.
2 mol de dichlore réagit avec 4 mol d'ion hydroxyde ; la soude est en excès d'une mole.
[HO-aq] = 1 /5 = 0,20 mol / L ; [Na+aq] =1,0 mol / L.
[Cl-aq]=[ClO-aq] =2 / 5 = 0,40 mol / L.
Degré chlorométrique d'une eau de Javel.
En milieu acide, l'eau de Javel subit une transformation totale selon le bilan :
ClO-aq +Cl-aq +2H+aq --> Cl2aq +H2O. (2)
Pour vérifier l'indication portée sur l'étiquette ( 12 °chl), on dilue
5 fois cette solution commerciale, puis on réalise un titrage indirect
d'un volume V = 10,0 mL de la solution diluée.
2.1 Principe du dosage.
On ajoute un excès d'ion iodure I-aq à un volume connu de solution d'eau de Javel.
ClO-aq + 2I-aq +H2O--> Cl-aq +I2aq +2HO-aq (3).
Le diiode formé est titré par les ions thiosulfates S2O32-aq.
Ecrire les demi-équations électroniques et l'équation de la réaction de titrage.
I2 aq + 2e- --> 2I- aq.
2S2O32-aq --> S4O62-aq + 2e-.
2S2O32-aq + I2 aq --> S4O62-aq + 2I- aq. (4).
2.2. Dosage du diiode formé.
Concentration de la solution titrante de thiosulfate de sodium C1=0,10 mol/ L. Volume équivalent VE = 20,0 mL.
2.2.a. Calculer la quantité de matière de diiode formé lors de la réaction (3).
A l'équivalence : n(S2O32-aq) =C1 VE =0,10 x 20,0 = 2,0 mmol.
n(I2) = 0,5 n(S2O32-aq) = 1,0 mmol.
2.2.b. En déduire que la quantité de matière d'ion hypochlorite initialement présente dans le volume V est égale à 1,0 mmol.
Au regard des coefficients stoechiométriques de la réaction (3) : n(I2) =n(ClO-aq) = 1,0 mmol.
2.2.c. Déterminer la concentration des ions ClO- dans la solution diluée puis dans la solution commerciale.
1,0 mmol dans 10 mL de solution diluée : (ClO-aq] =1,0 / 10 = 0,10 mol / L.
Concentration de ces ions dans la solution commerciale : 5 x0,10 = 0,50 mol/ L.
2.3 Détermination du degré.
2.3.a Calculer la quantité de matière de dichlore produite par 1,0 L d'eau de Javel commerciale par la réaction (2).
n(Cl2) =n(ClO-) =0,50 mol.
2.3.b Retrouver le volume molaire des gaz si T =0°C = 273 K et P = 1,013 105 Pa. R = 8,314 J mol-1 K-1.
Equation des gaz parfaits : PV =nRT.
Vm = RT / P = 8,314 x 273 /(1,013 105) =0,0224 m3 = 22,4 L / mol.
2.3.c. En déduire le degré chlorométrique de cette eau de Javel.
n(CI2) x volume molaire = 0,50 x22,4 = 11,2 L soit 11,2 °chl.
|
...
|
|
|
....
|
Cinétique de décomposition du pentaoxyde de diazote.
La décomposition est réalisée en phase gazeuse dans un récipient de volume constant V.
N2O5 (g) --> 2 NO2 (g) +½O2 (g).
1. On introduit n = 1,0 mol de pentaoxyde de diazote dans un récipient initialement vide de volume V = 10,0 L maintenu à T1 = 413 K. La pression initiale est P0.
1.a Déterminer les quantités de matière initiale et finales de chaque composé.
Initial : N2O5 (g) : 1,0 mol ; NO2 : 0 mol ; O2 : 0 mol.
Final :N2O5 (g) : 0 mol ; NO2 : 2,0 mol ; O2 : 0,50 mol, la réaction étant totale.
1.b Calculer la pression initiale.
P0 = nRT / V = 1,0 x8,314 x413 / 0,010 =3,43 105 Pa.
1.c Quelle sera la pression en fin de transformation ?
Pf = nRT / V = 2,5 x8,314 x413 / 0,010 =8,58 105 Pa.
2. On suit la cinétique de cette réaction d'ordre 1 par rapport à N2O5.
2.a. Etablir
l'expression de la pression partielle en fonction du temps en exprimant
la vitesse de deux façons différentes. On note la constante de vitesse k1.
v = -k1PN2O5 ; v = dPN2O5 /dt ; dPN2O5 / PN2O5 = -k1dt.
ln(PN2O5 ) = -k1t + Cste.
A t = 0, PN2O5 = P0, la constante d'intégration est égale à P0 : PN2O5 =P0 e-k1t.
2.b. Tracer l'allure de la courbe PN2O5 = f(t).
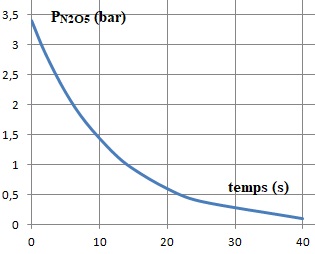
3. A 413 K, on constate qu'il reste 0,5 mol de N2O5 à la date t = 8,0 s. Calculer k1 en précisant son unité.
Il s'est formé 1 mole de NO2 et 0,25 mol de O2. ntotal =1,75 mol.
Ptot = 1,75 RT / V = 1,75 P0.
A t = 8 s, la pression partielle de N2O5 vaut : Ptot x0,5 / 1,75 =0,5 P0.
PN2O5 =P0 e-8 k1= 0,5 P0.
ln(0,5) = - 8 k1 .
k1 = ln(2) / 8 ~8,7 10-2 s-1 .
4. Si l'expérience est réalisée en partant de 2 moles de N2O5, au bout de combien de temps obtiendra-t-on le même rendement de 50 % ?
La pression initiale double ; PN2O5 =2P0 e-k1t.
A la date t : il reste 1 mol de N2O5 et il s'est formé 2 moles de NO2 et 0,5 mole de O2. Total : 3,5 mol.
Ptot = 3,5 P0. PN2O5 =P0 = 2P0 e-k1t.
0,5 = e-k1t ; ln(2) = k1 t ; t = ln(2) / (8,7 10-2) = 8 s.
5. Grâce à un manomètre on mesure la pression Ptotale dans le récipient de volume V
5.a. Montrer que Ptotale = 2,5 P0 -1,5 P0 e-k1 t.
A une date t, il disparaît x mol de N2O5, il se forme 2x moles de NO2 et 0,5x mol de O2.
Nombre total de moles : 1-x+2x+0,5x =1 +1,5 x = 1 +1,5 -1,5+1,5x = 2,5 -1,5(1-x).
Ptotale = (2,5 -1,5(1-x))P0 = 2,5 P0 -1,5(1-x) P0 = 2,5 P0 -1,5PN2O5 =2,5 P0 -1,5 P0 e-k1 t.
5.b. Ce résultat est-il en accord avec les questions 1.b et 1.c ?
A t = 0 ; Ptotal = 2,5 P0 -1,5 P0 = P0.
Au bout d'un temps suffisamment long, le terme en exponentielle est nul et Ptotal = 2,5 P0 . Donc accord avec les questions 1.b et 1.c.
6. L'expérience est réalisée à T2 = 363 K et on mesure un temps de demi-réaction de 9 min.
6.a. Calculer la valeur de la constante de vitesse k2 à cette température.
k2t½ = ln 2, cinétique d'odre 1.
k2 = ln(2) / t½ = ln(2) / (9 x60) =1,28 10-3 s-1.
6.b. Qu'appelle t-on énergie d'activation Ea d'une réaction ?
Elle représente l'énergie nécessaire pour que la réaction puisse se produire.
6.c. Montrer que 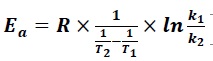 et calculer sa valeur. et calculer sa valeur.
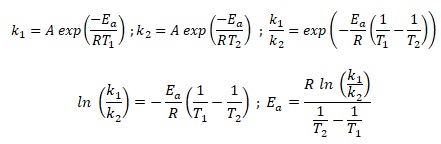
ln(0,087 /(1,28 10-3)) = 4,219 ; 1 /363 -1 /413 =3,335 10-4 ;
Ea =8,314 x4,219 / (3,335 10-4) = 1,05 105 J / mol.
|
Pot catalytique, conversion de CO en CO2.
Structure du carbone.
1.1. Donner les configurations électroniques des atomes d'oxygène et de carbone.
C : 1s2 2s2 2p2 ; O : 1s2 2s2 2p4 .
1.2 Proposer un schéma de Lewis de la molécule de dioxyde de carbone.
Diagramme d'Ellingham de l'élément carbone.
Soient les trois réactions suivantes mettant en jeu une mole de dioxygène.
(1) Oxydation du graphite en CO2 (g).
(2) Oxydation du graphite en CO gazeux : 2 C(s) + O2 (g) --> 2 CO(g).
(3) Oxydation du monoxyde de carbone en dioxyde de carbone.
2.1. Ecrire les équations des réactions (1) et '3).
(1) : C(s) +O2(g) --> CO2(g).
(3) : 2CO(g) + O2(g) --> 2 CO2(g).
2.2. Calculer pour
la réaction (2), l'enthalpie standard de réaction et l'entropie
standard de réaction à 298 K. Commenter le signe des valeurs.
DrH°2 = 2DfH°(CO) - DfH°(O2)- 2 DfH°(C) = 2 x( -110,5) = -221 kJ / mol.
DrS°2 = 2S°(CO) - S°(O2)- 2 S°(C) = 2 x197,7-205,1 -2 x5,7 = 178,9 J K-1 mol-1.
DrH°2 < 0 : réaction exothermique.
DrS°2 >0 : le désordre augmente, le nombre de molécules gazeuses dans l'état final est supérieur à celui de l'état initial.
2.3 Rappeler en quoi consiste l'approximation d'Ellingham.
L'enthalpie standard de réaction et l'entropie
standard de réaction sont indépendants de la température.
2.4 Donner l'expression de l'enthalpie libre standard DrG°2 de la réaction 2.
DrG°2 = DrH°2 -T DrS°2 = -221 - 0,1789 T. ( kJ / mol).
2.5. On donne DrG°1 = -394 -3,01 10-3 T et DrG°3 = -566 +1,73 10-1 T.
Attribuer à chaque droite du diagramme la réaction correspondante.
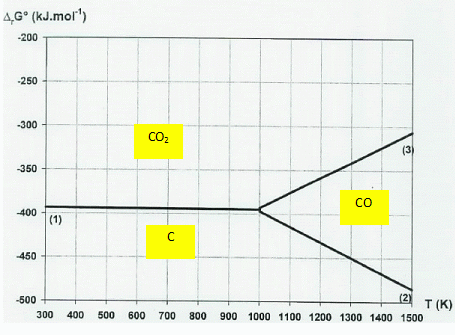
2.6.Justifier la simplification de ce diagramme pour une température inférieure à 980 K.
A une température comprise entre 300 K et 1000 K, CO(g) ne prédomine pas.
De l'or dans les pots catalytiques ?
1. Le pot catalytique.
3.1. Définir le terme catalyse.
Un catalyseur accélère une réaction thermodynamiquement possible.
3.2. Dans le cas du pot catalytique, de quel type de catalyse s'agit-il ? Justifier.
Le catalyseur est un solide ; les réactifs et produits sont des gaz. Donc catalyse hétérogène.
3.2 Structure cristalline de l'or.
Il cristallise dan un réseau cubique faces centrées. Les atomes d'or
sont assimilés à des sphères rigides de rayon r = 144,2 ppm.
3.2.a. Compléter la maille conventonnelle de l'or.
Établir la relation entre le rayon r de l’atome d’or et le paramètre a de la maille.
En déduire la valeur numérique du paramètre de maille a.
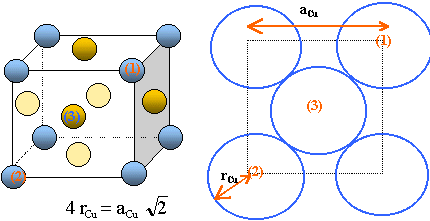
Déterminer le nombre d’atomes par maille.
Chaque maille compte en propre :
- Chaque atome d'or situé au centre d'une face, donc
commun à deux mailles compte pour ½ : il y a 6 faces soit 6*0,5 = 3
atomes d'or.
- Chaque atome situé à un sommet, donc commun à huit
mailles compte pour 1/8 : il y a huit sommets donc 8 /8 = 1atome d'or.
Total : 4 atomes d'or par maille.
Exprimer, puis calculer la masse volumique de l’or. Commenter.
masse d'un atome d'or : masse molaire de l'or / nombre
d'Avogadro = 197 10-3/ 6,02 1023
= 3,27 10-25 kg.
masse des atomes propres à une maille :
m =4*3,27 10-25 =1,31 10-24 kg.
volume de la maille a'3 m3 avec a = 4 r /1,414 = 4*144,2 10-12 / 1,414 =4,08 10-10 m.
La masse volumique de l'or est m / a3 =1,31 10-24 /(4,08 10-10)3= 1,93 104 kg m-3.
La masse volumique de l'or est très élevée par rapport à de nombreux métaux.
3.3 Le diagramme ci-dessous représente le taux de conversion de CO en fonction de la température pour :
- des nano composites à base d'or : 2,3 % AuTiO2 ( 2,3 % d'or dans le nano composite TiO2.
- le pot catalytique commercial Pt/Al2O3.
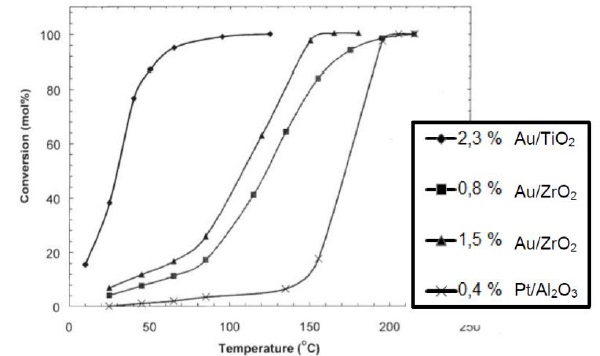
Quelle amélioration notable apporte le remplacement du métal platine par l'or ?
Le pot catalytique 2,3 % AuTiO2 élimine les gaz toxiques à une température plus basse que le pot catalytique Pt/Al2O3. Le pot 2,3 % AuTiO2 est efficace même pour les petits trajets.
|
|
|

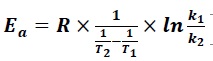 et calculer sa valeur.
et calculer sa valeur.