Chimie,
école de santé des armées ESA 2019.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
Exercice 1.
Le spectre RMN ci-dessous est celui de l'une des trois molécules A, B ou C suivantes :
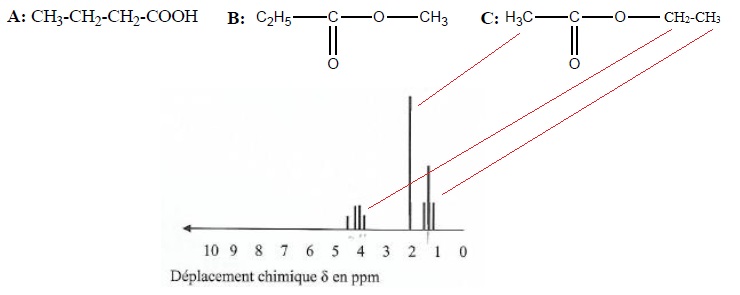
1. Nommer ces molécules.
A : acide butanoïque ; B : propanoate de méthyle ; C : éthanoate d'éthyle.
2. Ces molécules sont-elles stéréoisomères ? Justifier.
Non, elles n'ont pas la même formule semi-développée.
3. Quelle est l'isomérie commune qui existe entre ces 3 molécules ?
Isomérie de fonctions.
4. Attribuer le spectre RMN en justifiant chaque signal..
Exercice 2.
Une huile essentielle de densité 0,90 contient 2 % en masse de jasmone.
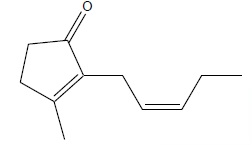
1. Calculer la masse molaire de la jasmone.
C11H16O ; M = 164 g / mol.
2. Définir carbone asymétrique.
C'est un carbone tétragonal lié à 4 atomes ou groupes d'atomes différents.
3. Préciser le nombre d'atomes de carbone asymétrique présent dans la jasmone.
Aucun.
4. Définir deux diastéréoisomères. Combien cette molécule en possède-t-elle ?
Deux diastéréoisomères sont des isoméres de configuration qui nne sont pas des énantiomères.
Une isomérie de type Z E ( 2 diastéréoisomères)..
5. Calculer la masse de jasmone contenue dans 25 mL d'huile essentielle.
Masse m = 0,90 x 25 = 22,5 g ; 22,5 x 0,02 ~0,45 g.
Exercice 3.
On
souhaite doser la quantité d'acide acéthylsalicylique, noté HA,
contenue dans un comprimé d'aspirine. Celui-ci est dissout dans l'eau
distillée pour donner une solution S0 de volume V0 de pH = 2,8.
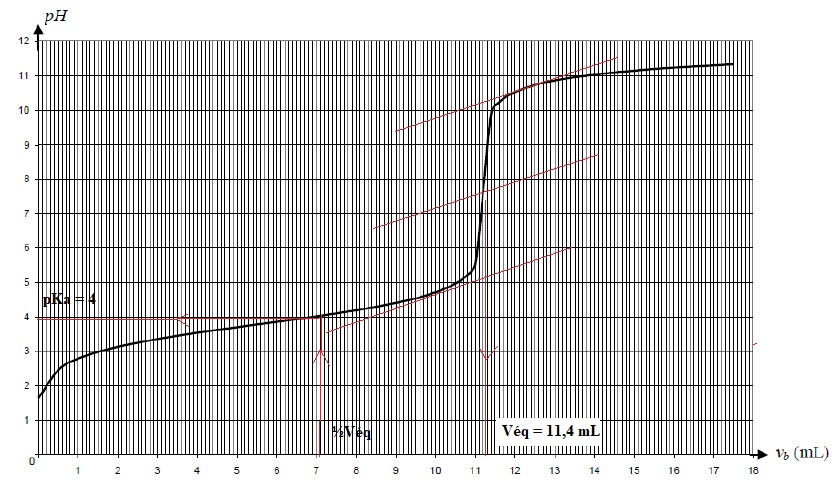
On prélève un volume Va = 5,0 mL de cette solution que l'on dose par une solution d'hydroxyde de sodium de concentration C = 0,010 mol / L.
1. Nommer et désigner les fonctions chimiques présentes.
2. Ecrire l'équation de la réaction de titrage.
AH aq + HO-aq --> A-aq + H2O(l).
3. La concentration C0 en aspirine contenu dans la solution S0 est Ca = 0,45 mol / L. Vrai ou Faux. Justifier.
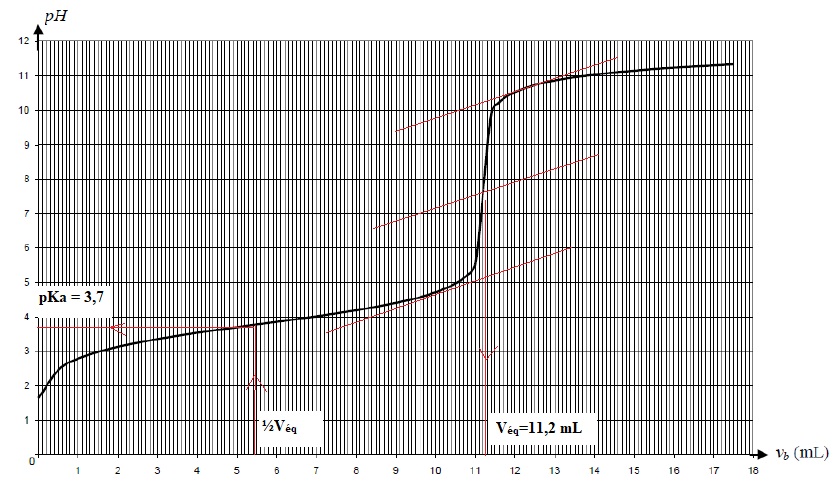
A l'équivalance Va Ca =C Véq ; Ca = 0,010 x11,2 / 5,0 ~0,022 mol / L.
4. Déterminer graphiquement la valeur du pKa du couple AH / A-.
5. Quelle espèce prédomine dans la solution S0 ? Justifier.
A pH inférieur à pKa, la forme AH prédomine.
|
...
|
....
|
Exercice 4.
Soient les 4 représentations suivantes de l'acide ascorbique.
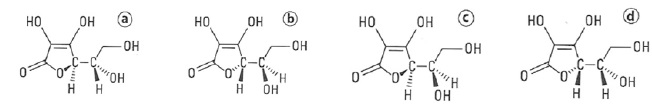
1. Combien y a-t-il d'atomes de carbone asymétriques ?
Deux.
2. Parmi les 4 représentations, existe-t-il des couples représentant 2 stéréoisomères de conformation ? Si oui, combien.
Il n'y a pas de stéréoisomères de conformation.
C. Définir deux énantiomères.
Deux énantiomères sont images l'un de l'autre dans un miroir plan.
D. Quels sont les couples d'énantiomères ?
Couple ( a , b ) ; couple (c , d ).
E. Quels sont les couples de diastéréoisomères ?
Couple ( a , d ) ; couple (c , b ).
Exercice 5.
Un organomagnésien est noté R-Mg-Br. R est le groupe vinyle CH2=CH-CH2-. Un organomagnésien réagit avec un composé contenant un groupe carbonyle, en deux étapes.
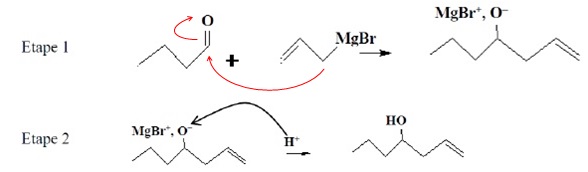
1. Donner la polarisation de la liaison C-Mg dans l'organomagnésien.
Le carbone porte une charge partielle négative et le magnésium une charge partielle positive.
2. Donner la polarisation de la liaison C=O.
Le carbone porte une charge partielle positive et l'oxygène une charge partielle négative.
3. Avec au maximum deux flèches courbes indiquer le mécanisme de l'étape 1.
4. Quelle est la catégorie de la réaction de l'étape 1 ? Justifier.
Addition sur la double liaison C=O. Les deux molécules se combinent
pour former une molécule plus grande ; disparition de la double liaison
C=O et formation de deux nouvelles liaisons simples.
E. Le mécanisme de l'étape 2 est-il correctement écrit ?
Non, la flèche doit pointée en sens contraire, de O- vers H+.
Exercice 6.
On dissout 13,9 g de chlorure d'hydroxylammonium de formule NH3OHCl(s)
dans un volume d'eau. La réaction de dissolution est totale et le
volume après dissolution est égal à 20 L. La solution obtenue ( NH3OH+aq + Cl-aq de concentration molaire C a un pH voisin de 4,0.
pKa(NH3OH+aq / B) = 6 ; pKa ( NH4+ / NH3 aq) = 9,2. M(NH3OHCl) =69,5 g / mol.
1. Donner la formule brute de la base B. Ecrire la réaction acidobasique de l'ion hydroxylammonium avec l'eau.
B désigne NH3O aq.
NH3OH+aq +H2O = NH3O aq +H3O+aq.
2. L'ion NH3OH+aq est-il un acide plus ou moins dissocié dans l'eau que NH4+ aq.
pKa(NH3OH+aq / B) < pKa ( NH4+ / NH3 aq).
A concentration égale, NH3OH+aq est un acide fort plus fort que NH4+ aq. NH3OH+aq est le plus dissocié dans l'eau.
3. Calculer
la concentration molaire C et en déduire le pH de cette solution dans
l'hypothèse où l'hydroxylammonium serait un acide fort. Conclure.
n = 13,9 / 69,5 =0,2 mol dans 20 L. C = 0,2 / 20 = 0,010 mol / L.
Dans l'hypothèse d'un acide fort : pH = - log C = 2. Le pH mesuré étant supérieur à 2, l''hydroxylammonium est un acide faible.
4. Vérifier par le calcul que pKa(NH3OH+aq / B) = 6.
Ka = [NH3O aq][H3O+aq] / [NH3OH+aq].
[NH3O aq] = [H3O+aq] ; [NH3OH+aq] ~C.
Ka ~[H3O+aq]2 / C =(10-4)2 / 0,010 = 10-6 ; pKa = 6.
|
|