Chimie
analytique, concours interne technicien principal police technique et
scientifique 2016.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
Partie A.
Pour mettre en évidence la présence de sucre dans un prélèvement on
utilise le réactif de Potterat ( EDTA cuivreux), préparé à partir du
sulfate de cuivre, d'EDTA et de carbonate de sodium.
A 1 mL de la solution aqueuse à tester, ajouter 25 µL d'acide
sulfurique concentré puis chauffer 10 minutes au bain marie. Réajuster
le pH à 7 ou plus.
Enfin ajouter 1 mL du réactif de Potterat et laisser 10 minutes
au bain marie. l'apparition d'un précipité rouge brique indique la
présence d'un sucre réducteur tel que le glucose.
1. Quelle substance ajoutez-vous à la solution pour ajuster le pH.
Le pH initial étant 6,5, on ajoute de la soude pour amener le pH à 7 ou plus.
2. Donner la projection de
Fischer du glucose et localiser les groupes fonctionnels. La molécule
possède -t-elle un atome de carbone asymétrique ?
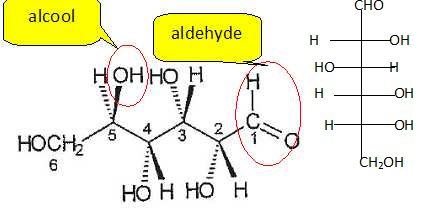
Les atomes de carbone n°2, 3, 4 et 5 sont asymétriques.
3. Ecrire les demi-équations puis l'équation bilan de la réaction sachant qu'elle met en jeu les couples Redox Cu2+/Cu2O et gluconate RCOO- / glucose RCHO.
2 Cu2+ +2e- +2HO- -->Cu2O +H2O.
RCHO +3HO- --> RCOO- +2e- +2H2O.
RCHO +2 Cu2+ +5HO- --> RCOO- +Cu2O + 3H2O.
4. A quelles espèces chimiques sont dues les colorations bleue et rouge des solutions initiale et finale ?
Cu2+ aqueux donne une coloration bleue à la solution.
Cu2O donne la couleur rouge brique au précipité.
5. Que signifie les lettres ITRF ?
Ingénieurs et personnels Techniques de Recherche et de Formation.
6. Citer une autre technique analytique qui aurait pu être utilisée pour détecter les sucres.
Chromatographie.( HPLC)
7. Expliquer la première étape ( ajout d'acide sulfurique à la solution ) du test de Potterat.
En milieu acide dilué, le glucose ne réagit pas.
Partie B.
L'analine sulfurique a permis de mettre en évidence la présence d'ion chlorate.
Le chlore 17Cl a une masse atomique ACl = 35,453 u et est présent à l'état naturel sous forme de 2 isotopes stables : 35Cl et 37Cl.
8. Qu'est ce qu'un isotope ? Calculer la composition atomique du chlore 35Cl et 37Cl.
Deux isotopes ne diffèrent que par leur nombre de neutrons ; ils ont le même numéro atomique Z.
35Cl : 17 protons et 35-17 = 18 neutrons ; 37Cl : 17 protons et 37-17 = 20 neutrons.
9. Donner la configuration électronique de l'atome à l'état fondamental. A quelle famille appartient le chlore ?
1s2 2s2 2p6 3s2 3p5. Famille des halogènes.
10.
Quel est le degré d'oxydation du chlore dans les ions chlorates ? Citer
un autre composé chimique contenant du chlore à un degré d'oxydation
différent.
ClO4- : n.o(Cl )+4 (-2) = -1 ; n.o(Cl) =+VII.
Ion hypochlorite ClO-.
Partie C.
Les mélanges chlorate-sucre sont des explosifs artisanaux dont les
proportions idéales sont : 72 % chlorate de sodium et 28 % saccharose.
Le mélange doit être homogène.
11. Définir une explosion chimique.
Une explosion est une augmentaion rapide de volume et une libération d'énergie avec génération de hautes température et de gaz..
12. Quels gaz pourraient libérés au cours de la réaction lors de l'explosion chlorate-sucre ?
CO2 et H2O.
Partie D.
13. Que signifie l'acronyme FNAEG ?
Fichier Nationnal Automatisé des Empreintes Génétiques.
14. Qu'est qu'un catalyseur ?
Un catalyseur accélère une réaction thermodynamiquement possible. Il
n'apparaît pas dans le bilan de la réaction, étant régénéré lors de la
dernière étape du processus.
15.
L'acylation conduit à la formation d'un ester. Quel(s) groupe(s) de la
molécule de sucre est acétylé ? Ecrire schématiquement la réaction
d'acylation.
Les groupes OH de la molécules de sucres sont acétylés.
R--OH + R'COOH = R'COO-R + H2O.
16. Sous quel nom est plus connu la MDMA sous forme de comprimé ?
ecstasy.
17. Pourquoi
les sucres sont-ils acétylés avant l'analyse en GC/MS ? Quelle autre réaction produit le même effet ?
Les sucres sont des molécules polaires ( présence des groupes OH). Les esters sont moins polaires que les sucres.
Protection en fonction éther oxydes.
18. Les sucres peuvent être analysés en HPLC, quel type de détecteur est le plus adapté ?
Réfractométrie différentielle.
Le comprimé est acéthylé dans le chloroforme par l'anhydride acétique,
la réaction est catalysée par de l'imidazole. Outre la MDMA, les
analyses mettent en évidence la présence d'un sucre de formule brute C12H22O11.
19. Quel sucre est utilisé comme excipient ? A quel composé correspond le pic à 14,53 min ?
Le lactose.(Tr = 35,12 min).
Le pic à 14,53 min correspond au MDMA.
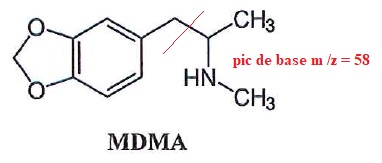
20. Proposer une méthode simple pour évaluer la quantité de MDMA dans le comprimé.
Il suffit d'étudier le rapport des aires Ai / AE ( Ai aire du pic de l'analyte ; AE aire du pic de l'étalon interne). Le pic de l'étalon interne sert d'échelle.
Partie E.
Les cheveux sont analysés en toxicologie pour la recherche de
substances médicamenteuses, dans le cas présent pour la recherche
spécifique de rispéridone et de 9-OH-rispéridone.
La mèche de 4,2 cm de long est dans un premier temps décontaminée dans
des bains successifs de dichlorométhane. Il est ensuite découpé en
tronçons de 1 cm correspondant chacun à environ 1 mois de pousse du
cheveu.

Chaque troncon est broyé. Pour chaque tronçon, 20 mg environ de ce
broyat sont recueillis, additionnés d'un standard interne deutéré,
hydrolysés puis extraits par un mélange dichlorométhane / éther.
L'extrait est analysé par LC/MS/MS.
Dans le même temps, une gamme de calibration, un blanc et un contrôle
positif à 150 pg / mg sont préparés dans les mêmes conditions.
l'incertitude de la méthode est de 20 %.
21. Quel est l'apport de l'analyse des cheveux en toxicologie médico-légale ?
L'analyse d'urine et l'analyse de sang fournissent des informations à
court terme de la consommation de drogues. L'histoire à long terme
n'est possible que par l'analyse des cheveux ( distinction entre
l'utilisation chronique et d'une exposition unique aux drogues ).
22. Quel est le rôle de l'étalon interne ?
Le pic de l'étalon interne sert d'échelle.
23. Que signifie ce pictogramme ?
Cancérogène, tératogène.
24. Quels sont vos protections individuelles lors de la manipulation ?
Protection des yeux et du visage : lunette, écran facial.
Protection de la peau : gants, tabliers, bottes.
Protection des voies respiratoires : appareil respiratoire autonome muni d'un masque complet.
2
Un métabolite est un composé organique intermédiaire ou issu du
métabolisme. Ce terme est réservé aux petites molécules ( monomère) par
opposition aux macromolécules. Par exemple le glucose est un
métabolite, contrairement au glycogène.
Un métabolite est un composé organique intermédiaire ou issu du
métabolisme. Ce terme est réservé aux petites molécules ( monomère) par
opposition aux macromolécules. Par exemple le glucose est un
métabolite, contrairement au glycogène.10. Qu'est-ce q'un métabolite ? Quelles indications peut fournir leur présence ?
Un métabolite est un composé organique intermédiaire ou issu du
métabolisme. Ce terme est réservé aux petites molécules ( monomère) par
opposition aux macromolécules. Par exemple le glucose est un
métabolite, contrairement au glycogène.
La présence des molécules mères retrouvées dans la salive, révèlent la consommation des 24 dernières heures.10. Qu'est-ce q'un métabolite ? Quelles indications peut fournir leur présence ?
Un métabolite est un composé organique intermédiaire ou issu du
métabolisme. Ce terme est réservé aux petites molécules ( monomère) par
opposition aux macromolécules. Par exemple le glucose est un
métabolite, contrairement au glycogène.
La présence des molécules mères retrouvées dans la salive, révèlent la consommation des 24 dernières heures.
26. Rappeler brièvement le principe de la spectrométrie de masse en tandem. En LC/MS/MS quel est le rôle de la source ESI ?
Spectromètre de masse MSMS : sélection de l'ion à fragmenter ;
fragmentation de cet ion ; analyse des ions issus de la fragmentation.
Les
ions séparés par une simple MS sont sélectionnés dans un collecteur et
sont fragmentés. Les fragments sont analysés dans un deuxième
analyseur. L'identification est plus fine et plus exacte.
Source ESI : Dispersion d'un liquide sous forme de gouttelettes chargées électriquement.
26. Tracer la courbe Aire Rispéridone / Aire EI en fonction de la quantité de matière.
Concentration (pg / mg)
|
0
|
20
|
50
|
100
|
150
Contrôle
|
300
|
500
|
T1
|
T2
|
T3
|
T4
|
| Aire Rispéridone / Aire EI |
0
|
0,016
|
0,041
|
0,074
|
0,119
|
0,192
|
0,338
|
0,0343
|
0,113
|
0,0024
|
7,7 10-5
|
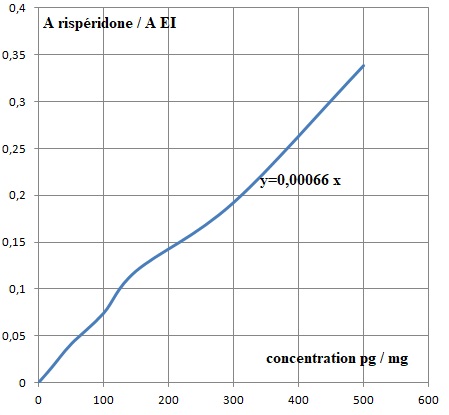
28. En déduire la concentration de Rispéridone pour chaque tronçon.
T1 : 0,0343 / 0,00066 ~52 pg / mg.
T2 : 0,113 / 0,00066 ~171 pg / mg.
T3 : 0,0024 / 0,00066 ~3,6 pg / mg.
T4 : 7,7 10-5 / 0,00066 ~0,12 pg / mg.
Contrôle : 0,119 / 0,00066 ~180 pg /mg.
La
consommation de Rispéridone a été insignifiante il y a plus de deux
mois, a été importante il y a deux mois, puis a diminué au cours de ce
mois.
|
...
|
....
|
Préparation d'une solution tampon.
1. De quoi est composé une solution tampon.
Une solution tampon contient un couple Acide / Base. Les deux espèces sont présentes.
pH = pKa + log ([base] / [acide conjugué])
2. A quoi sert une solution tampon ?
Dans une solution tampon, le pH varie peu suite à l'ajout modéré d'un acide fort ou d'une base forte.
On dispose d'une bouteille d'acide éthanoïque M = 60,05 g / mol ; d = 1,05.
3. Quel est le nom usuel de cet acide ?
Acide acétique.
4. Que signifie le pictogramme 
5. Ecrire les différents équilibres chimiques qui s'établissent dans une solution aqueuse d'acide éthanoïque.
CH3COOH aq = CH3COO- aq + H+aq.
H2O(l)=HO- aq + H+aq.
6. Exprimer la constante d'acidité du couple considéré.
Ka = [CH3COO- aq] [H+aq] / [CH3COOH aq].
7. On veut préparer 1,0 L de solution d'acide éthanoïque à 0,1 mol / L. Quel volume faut-il prélevé ?
Solution commerciale : masse de 1 L : 1,05 kg = 1050 g.
Concentration : 1050 / 60,05 ~17,5 mol / L
Facteur de dilution : 17,5 /0,1 = 175.
Volume à prélever 1000 / 175 ~0,0057 L = 5,7 mL.
8. Quel matériel choisir ? Comment procéder ?
Prélever 5,7 mL de solution commerciale ( burette graduée ); verser
dans une fiole jaugée de 1,0 L contenant 1 /3 d'eau distillée.
Compléter jusqu'au trait de jauge avec de l'eau distillée. Agiter pour rendre homogène.
9. On veut préparer 1,0 L de solution d'éthanoate de sodium à 0,1 mol / L. Comment procéder ?
M(CH3COONa) =82 g / mol.
Quantité de matière : 0,1 mol ; masse à peser : 82 x0,1 = 8,2 g.
Peser 8,2 g de solide, verser dans une fiole jaugée de 1,0 L munie d'un
entonnoir à solide. Rincer coupelle de pesée et entonnoir. Ajouter 1/3
d'eau distillée et agiter jusqu'à dissolution complète.
Compléter jusqu'au trait de jauge avec de l'eau distillée. Agiter pour rendre homogène.
10. A partir des
deux solutions précédentes, on désire préparer 600 mL de solution
tampon à pouvoir tampon maximal. Quel volume de chaque solution faut-il
utiliser ?
A pouvoir tampon maximal, pH = pKa ( acide éthanoïque / ion éthanoate)= 4,8.
[acide éthanoïque] = [ion éthanoate].
Les concentrations des solutions étant identiques, les volumes seront identiques, égaux à 300 mL.
On peut vérifier le pH à l'aide d'un pHmètre.
Préparation d'une solution de KMnO4 à 0,02 M.
1. Définir molarité.
La concentration molaire est appelée molarité ; solution molaire : un litre solution contient une mole de soluté.
2. Quelle est la relation entre M et N (normalité) en prenant le couple MnO4- / Mn2+?
MnO4- +8H+ +5e- = Mn2++4H2O.
Normalité = Molarité fois nombre d'électrons échangés.
N = 5 M.
3. Calculer la masse molaire de KMnO4..
39,1 +54,9 +4x16 =158 g / mol.
4. Quelle quantité de KMnO4 solide faut-il dissoudre dans 250 mL d'eau pour obtenir une solution 0,02 M ?
Quantité de matière KMnO4 : 0,02 x0,250 =0,005 mol.
Masse de solide : 158 x0,005 =0,79 g.
5. Quelle est la propriété chimique de KMnO4 utilisée en chimie ? Quelle précaution faut-il prendre pour conserver la solution ?
En milieu acide, la solution est oxydante.
L'ion MnO4- oxyde lentement l'eau, réaction accélérée par les UV.
Conservation durant quelques semaines dans un flacon opaque brun, en milieu acide.
|
|





