Les
ions ferreux essentiels pour le transport du dioxygène dans le sang,
enseignement de spécialité, classe de première générale.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
.
.
|
.
..
.....
|
Dans
cet exercice, on étudie d’abord l’oxydation des ions ferreux en ions
ferriques. Ensuite, une méthode de dosage de l’hémoglobine dans le sang
et le traitement d’une carence en fer sont abordés.
1. Oxydation des ions ferreux.
Une expérience est menée en laboratoire pour illustrer la capacité de l’ion permanganate à oxyder les ions ferreux.
Dans un bécher contenant 40 mL d’une solution de sulfate de fer(II) (Fe2+(aq) + SO42-(aq)) de concentration en quantité de matière égale à 2,5 10-1 mol·L-1, on introduit 20 mL d’une solution aqueuse de permanganate de potassium (K+(aq) + MnO4-(aq)) de concentration en quantité de matière 1,0 10-1 mol·L-1 contenant aussi des ions H+. Les solutions avant mélange et après le mélange ont été photographiées et figurent ci-dessous.

Couples oxydant/réducteur :
- Fe3+(aq)/Fe2+(aq) ;
- MnO4-(aq)/Mn2+(aq) dont la demi-équation électronique s’écrit :
MnO4-(aq) + 8 H+(aq) + 5 e− = Mn2+(aq) + 4 H2O(ℓ).
1.1. À l’aide des observations, montrer qu’une transformation chimique a bien eu lieu.
Initialement la solution de permanganate de potassium est violette ( couleur due aux ions MnO4-aq) et la solution de sulfate de fer (II) est verdâtre ( couleur due à l'ion Fe2+aq).
Après mélange, la solution finale est orangée ( couleur due à l'ion Fe3+ aq).
1.2. Identifier les oxydants et les réducteurs consommés et ceux qui sont produits.
MnO4-aq joue le rôle d'oxydant, il est réduit en ion Mn2+aq.
Fe2+aq joue le rôle de réducteur, il s'oxyde en Fe3+aq.
1.3. On souhaite modéliser la transformation par une réaction oxydant-réducteur.
1.3.1. Écrire la demi-équation électronique du couple Fe3+(aq)/Fe2+(aq).
5 Fe2+aq = 5 Fe3+aq + 5e-.
1.3.2. Vérifier que l’équation de la réaction oxydant-réducteur modélisant la transformation chimique s’écrit :
MnO4-(aq) + 5 Fe2+(aq) + 8 H+(aq) → Mn2+(aq) + 5 Fe3+(aq)+ 4 H2O (ℓ).
MnO4-(aq) + 8 H+(aq) + 5 e− = Mn2+(aq) + 4 H2O(ℓ).
5 Fe2+aq = 5 Fe3+aq + 5e-.
Ajouter : MnO4-(aq) + 8 H+(aq) + 5 e− +5 Fe2+aq= Mn2+(aq) + 4 H2O(ℓ) + 5 Fe3+aq + 5e-.
Simplifier : MnO4-(aq) + 5 Fe2+(aq) + 8 H+(aq) → Mn2+(aq) + 5 Fe3+(aq)+ 4 H2O (ℓ).
1.3.3. Justifier, à l’aide des données, que MnO4-(aq) et Fe2+(aq) sont introduits en proportions stoechiométriques dans le mélange initial.
n(MnO4-(aq)) = 20 x0,1 = 2,0 mmol.
n(Fe2+aq) =40 x0,25=10 mmol.
D'après les nombres stoechiométriques de l'équation, 2 mmol d'ion permanganate réagit avec 2 x5 = 10 mmol d'ion fer (II).
|
| ..
... |
.
.
|
Cette
modélisation de la transformation sert de support pour rédiger un
programme en langage python. Ce programme permet de visualiser
l’évolution des quantités de matière des ions permanganate et des ions
ferreux dans le système précédent en fonction de l’avancement de la
réaction noté x.
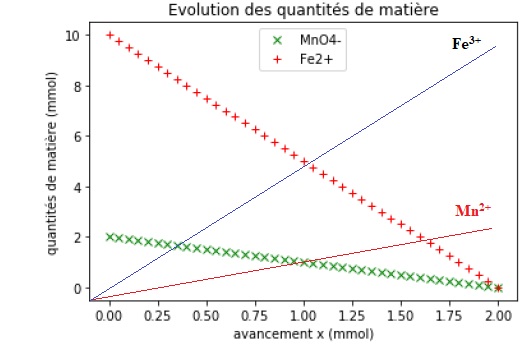
1.4. Indiquer la ligne du programme codant l’information correspondant à une transformation totale. Justifier.
Ligne 20. La boucle While fonctionne tant qu'il y a des ions permanganate et des ions ferreux.
1.5. Établir un tableau d’avancement de la réaction et vérifier que la valeur de l’avancement maximal est compatible avec le tracé.
|
Avancement ( mmol)
|
MnO4-(aq) |
+ 5 Fe2+(aq) |
+ 8 H+(aq) |
→ Mn2+(aq) |
+ 5 Fe3+(aq) |
+ 4 H2O (ℓ). |
initial
|
0
|
2
|
10
|
en excès
|
0
|
0
|
Solvant,
large excès
|
en cours
|
x
|
2-x
|
10-5x
|
x
|
5x
|
final
|
x = 2
|
0
|
0
|
2
|
10
|
Les deux droites se coupent en ( 2 mmol ; 0).
1.6. Déduire du tableau d’avancement l’expression de la quantité de matière des ions Fe3+(aq) en fonction de l’avancement.
n(Fe3+aq) =5 x.
1.7. Écrire l’instruction permettant de calculer la quantité de matière de Fe3+(aq) pour une valeur d’avancement x et proposer un numéro de ligne où elle pourrait être insérée dans le programme.
Entre les lignes 24 et 25 : n_Ferrique. append((ni_Ferrique + 5*x))
1.8. Reproduire la figure 1 sur votre copie et tracer la représentation graphique de l’évolution de la quantité de matière d’ions Mn2+(aq) et celle de la quantité de matière d’ions Fe3+(aq). Voir ci-dessus.
|
. .
|
.
|
2. Dosage hémoglobine et traitement d’une carence en fer.
Quand l’organisme souffre d’une carence en fer, les hèmes contenus dans les globules rouges qui contiennent des ions Fe2+
ne sont plus suffisamment nombreux. Le taux d’hémoglobine est alors
trop faible pour assurer une oxygénation normale des organes. Un dosage
du taux d’hémoglobine permet de diagnostiquer une éventuelle carence et
de prescrire un traitement adapté aux besoins.
Principe du dosage de l’hémoglobine dans le sang par la « méthode de Drabkin »
Le réactif de Drabkin permet de transformer l’hémoglobine d’un
échantillon de sang en cyanméthémoglobine. On réalise ensuite un dosage
spectrophotométrique de la cyanméthémoglobine dans l’échantillon
analysé.
Protocole simplifié du dosage :
- ajout de 5 mL du réactif de Drabkin dans 20 μL d’échantillon de sang analysé ;
- mesure de l’absorbance A de la solution obtenue à une longueur d’onde de 546 nm ;
- ajout de 5 mL du réactif de Drabkin dans 20 μL d’échantillons de
référence de concentrations connues en hémoglobine. Mesures
d’absorbances et tracé d’une droite d’étalonnage).
2.1. Prévoir la teinte d’une solution aqueuse de cyanméthémoglobine.
Cette solution présente un maximum d'absorption vers 560 nm. ( couleur entre le vert et le jaune).
La solution possède la couleur complémentaire du jaune-vert, soit une teinte intermédiaire entre le violet et le rouge.
2.2. Expliquer le choix de la longueur d’onde de mesure d’absorbance.
Pour une meilleure précision, on se place au maximum d'absorption.
2.3. Un échantillon de sang d’une femme est analysé par la méthode de Drabkin et l’absorbance mesurée est de A = 0,26.
2.3.1. Indiquer si une carence en fer est diagnostiquée.
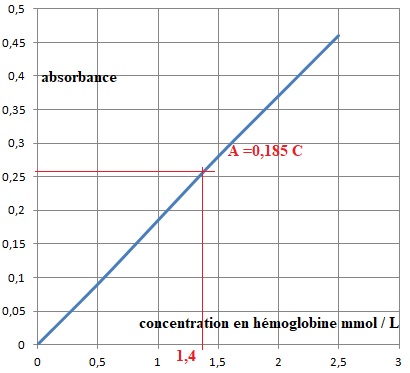
1,4 10-3 mol /L soit : 1,4 10-3 M(Hb) =1,4 10-3 x 64 103 =89,6 g / L.
Cette valeur est comprise entre 70 et 100 g /L : il s'agit d'une carence modérée.
2.3.2. Proposer un traitement adapté en déterminant le nombre de comprimés à prescrire par jour.
Pour une carence modérée, l'apport quotidien doit être de 100 mg d'ions Fe2+ pour une femme.
L'étiquette du médicament indique 136,00 mg de sulfate ferreux désséché FeSO4 par comprimé.
Masse d'ion fer (II) par comprimé : 136 M(Fe) / M(FeSO4) =136 x55,8 /(55,8 +32 +4 x16) ~ 50 mg.
Soit 2 comprimés par jour.
|
|
|



